Una donna di 77 anni veniva trasferita presso la nostra Struttura per importante dispnea, presente da diversi anni. La paziente aveva eseguito numerosi accertamenti diagnostici, i quali avevano attribuito la sintomatologia a riacutizzazioni di bronchite cronica ostruttiva. Alla luce di un’ulteriore ingravescenza della dispnea, avvenuto negli ultimi mesi, la paziente aveva acconsentito ad un nuovo ricovero per accertamenti. L’anamnesi personale constava inoltre di ipertensione arteriosa, dislipidemia, pregressa abitudine tabagica, pregressa evidenza di coronarie epicardiche indenni da lesioni significative, tiroidite cronica, ernia iatale, diabete mellito tipo II insulino-dipendente.
All’ingresso in reparto la paziente era emodinamicamente stabile (pressione arteriosa 130/80 mmHg, frequenza cardiaca 50 bpm), con una SO2 in aria/ambiente dell’86% ed una frequenza respiratoria di 20 apm. Durante la misurazione dei parametri vitali assistevamo inoltre ad un peggioramento della sintomatologia e della saturazione periferica dell’ossigeno all’assunzione della posizione seduta. Procedevamo quindi alla misurazione sia della saturazione periferica con pulsossimetro sia alla valutazione dell’emogasanalisi arteriosa sia in posizione supina (SO2 98%, pH 7.62, pO2 98 mmHg, pCO2 18 mmHg and HCO3, 23.7mmol/l) che in posizione seduta (SO2 86%, pH 7.52, pO2 48.7, pCO2 23.4, HCO3 22.5) avendo così modo di osservare che, da seduta, si assisteva ad un importante calo della saturazione. Anche il gradiente alveolo-arterioso si modificava passando da 30 mmHg in posizione supina a 73 mmHg in posizione seduta. Questa presentazione clinica ci fece quindi porre il sospetto di sindrome “platipnea-ortodeossia”.
L’obiettività risultava nella norma, fatta eccezione per la presenza di lievi e diffusi sibili apprezzabili ai campi polmonari. Veniva pertanto impostata ossigenoterapia con maschera di venturi al 35% di FiO2 (8 L/min). Gli esami ematici mostravano i seguenti valori: emoglobina 12.9 g/dl; piastrine, 220,000 cell/ml, eritrociti, 4,410,000 cell/ml, leucociti (WBC) 7.680 cell/ml (neutrofili 4420 cells/ml, linfociti 2120 cells/ml) e creatinina 1.06 mg/dl. Screening trombofilico negativo. L’elettrocardiogramma era nei limiti (figura 1) . La radiografia del torace non mostrava alterazioni parenchimali ma un sollevamento dell’emidiaframma destro (figura 2).

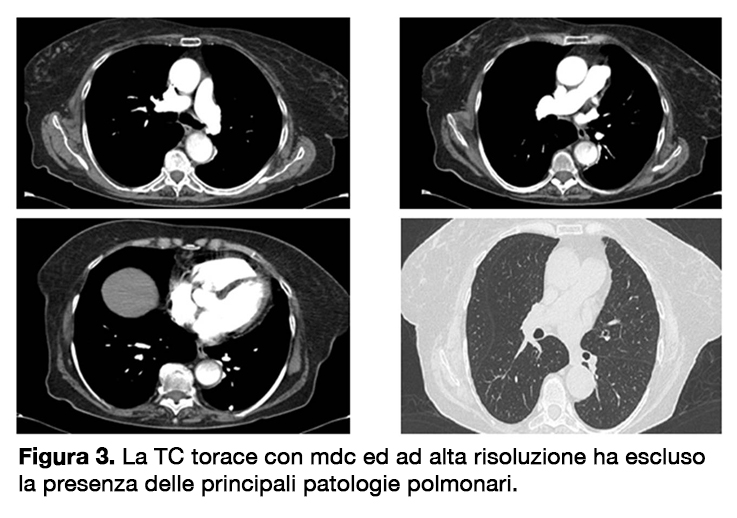
Allo scopo di escludere altre possibili cause di dispnea si eseguivano una spirometria, risultata nella norma (FEV1 2.17L, Tiffenau index 73%), così come un’angio TC del torace ed HRTC (figura 3) che escludeva la presenza di embolia polmonare, di fibrosi polmonare, polmonite ed enfisema ma che evidenziava una dilatazione delle arterie polmonari ed un assottigliamento del setto interatriale.
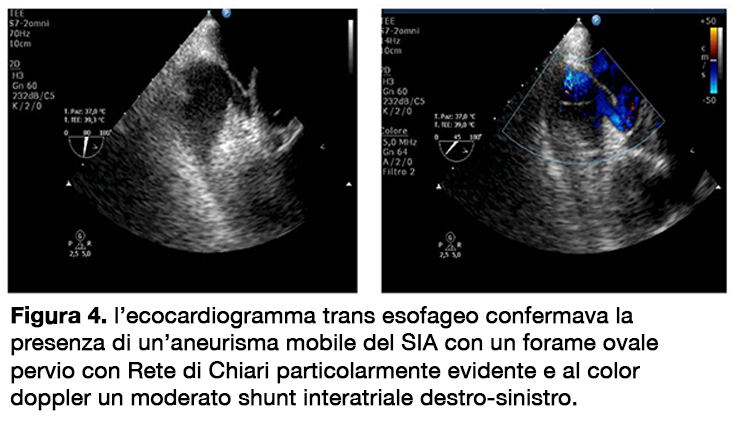
All’ecocardiogramma transtoracico, limitato da una elevata impedenza acustica del torace, si apprezzava una normale funzione funzione ventricolare sinistra, una lieve dilatazione dell’aorta ascendente (39 mm), una lieve insufficienza mitralica e la presenza di un’aneurisma del setto interatriale, in assenza di chiari shunt. Le sezioni destre apparivano mal valutabili e la qualità delle immagini non permetteva nè una valutazione morfologica e funzionale né una stima indiretta delle pressioni in arteria polmonare. Si procedeva pertanto all’esecuzione di un’ecocardiogramma transesofageo (decubito semi-seduto) (figura 4), anch’esso di difficile esecuzione con acquisizione di immagini off-axis, che confermava la presenza di un’ aneurisma mobile del SIA con evidenza di un forame ovale pervio con Rete di Chiari particolarmente evidente e al color doppler, in condizioni di riposo, un moderato shunt interatriale destro-sinistro. La valutazione delle sezioni destre era anche in questo caso severamente ostacolata.
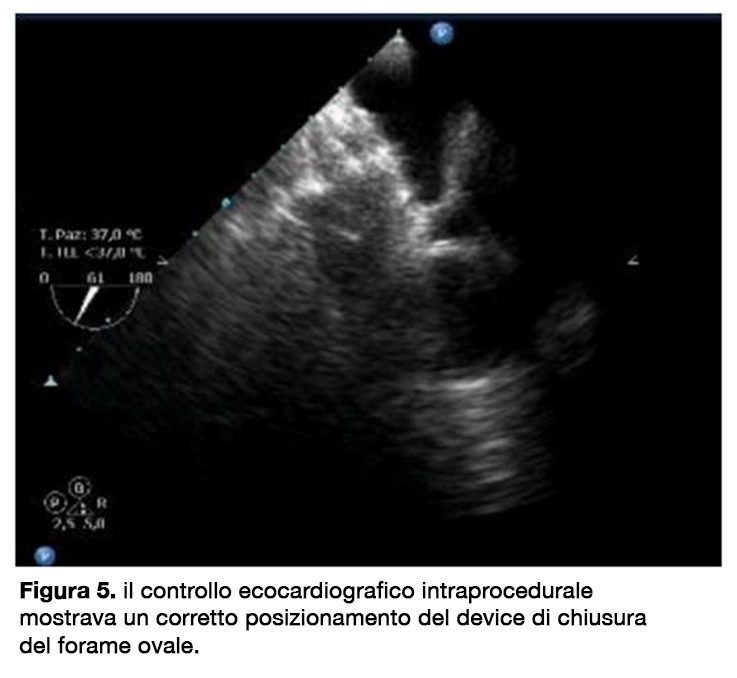
 Infine, il cateterismo cardiaco escludeva la presenza di malattia coronarica e confermava la presenza di un forame ovale pervio, in assenza di shunt tra atrio sinistro ed atrio destro (QP/ QS 1⁄4 1.07) (QP 1⁄4 flusso polmonare; QS 1⁄4 flusso sistemico) con normali pressioni in arteria polmonare (pressione sistolica in arteria polmonare 21 mmHg). Alla luce dei dati raccolti la paziente venne sottoposta a procedura di chiusura percutanea del PFO di successo, in assenza di complicanze, mediante impianto di un Amplatzer PFO Occluder 32/25 mm AGA Medical Corporation. I controlli ecocardiografici intra-procedurale (figura 5), il giorno dopo la procedura e ad un mese dalla procedura mostravano un corretto posizionamento del device, in assenza di shunt interatriali significativi. L’esecuzione post-procedurale dell’EGA in posizione supina (SO2 96%, pH 7.38, pO2 86 mmHg, pCO2 42 mmHg and HCO3, 23.9mmol/l) che in posizione seduta (SO2 96%, pH 7.38, pO2 86, pCO2 42, HCO3 24.5), così come il miglioramento della sintomatologia riscontrato dalla paziente, confermavano la risoluzione dello shunt. La paziente veniva pertanto dimessa in duplice terapia antiaggregante con acido acetilsalicilico e clopidogrel per tre mesi e successivamente in solo acido acetilsalicilico per ulteriori tre mesi.
Infine, il cateterismo cardiaco escludeva la presenza di malattia coronarica e confermava la presenza di un forame ovale pervio, in assenza di shunt tra atrio sinistro ed atrio destro (QP/ QS 1⁄4 1.07) (QP 1⁄4 flusso polmonare; QS 1⁄4 flusso sistemico) con normali pressioni in arteria polmonare (pressione sistolica in arteria polmonare 21 mmHg). Alla luce dei dati raccolti la paziente venne sottoposta a procedura di chiusura percutanea del PFO di successo, in assenza di complicanze, mediante impianto di un Amplatzer PFO Occluder 32/25 mm AGA Medical Corporation. I controlli ecocardiografici intra-procedurale (figura 5), il giorno dopo la procedura e ad un mese dalla procedura mostravano un corretto posizionamento del device, in assenza di shunt interatriali significativi. L’esecuzione post-procedurale dell’EGA in posizione supina (SO2 96%, pH 7.38, pO2 86 mmHg, pCO2 42 mmHg and HCO3, 23.9mmol/l) che in posizione seduta (SO2 96%, pH 7.38, pO2 86, pCO2 42, HCO3 24.5), così come il miglioramento della sintomatologia riscontrato dalla paziente, confermavano la risoluzione dello shunt. La paziente veniva pertanto dimessa in duplice terapia antiaggregante con acido acetilsalicilico e clopidogrel per tre mesi e successivamente in solo acido acetilsalicilico per ulteriori tre mesi.
Discussione
La sindrome platipnea-ortodeossia si distingue dalla classica dispnea che viene alleviata dalla posizione seduta ed esacerbata dalla posizione supina e rappresenta quindi l’opposto dell’ortopnea, essendo caratterizzata da una diminuizione dell’ossimetria nel passaggio dalla posizione supina all’ortostatismo (1-4). Le cause della sindrome possono essere sia intra- che extra-cardiache. Tra le cause extra-cardiache, sebbene più rare, vengono descritti in letteratura casi correlati alla presenza di mismatch ventilazione-perfusione a livello polmonare (malattie parenchimali polmonare, broncopneumopatia cronica ostruttiva, enfisema) o shunt artero-venosi polmonari (fistole e malformazioni artero-venose, sindrome epato-polmonare, sindrome Rendu-Osler) (5). Nel caso degli shunt intracardiaci, rappresentati da difetti del setto inter-atriale, forame ovale pervio o aneurisma del setto interatriale, si rende generalmente necessaria l’associazione con un’anomalia strutturale o funzionale a livello toracico o addominale, come nel caso della nostra paziente, ove abbiamo riscontrato una dilatazione dell’aorta ascendente ed il sollevamento dell’emidiaframma destro (1,6). Questo rende ragione del perché una sindrome spesso associata ad anomalie congenite, è invece caratteristica di soggetti di età avanzata. Soffermandoci sulla forma cardiaca della sindrome, è stata frequentemente dimostrata una distorsione del setto interatriale, che va a distrorcere l’anatomia delle camere destre, che altera la posizione del difetto interatriale, ponendolo in linea diretta con il flusso ematico proveniente dalla vena cava inferiore. Questo cambiamento anatomico sembra essere più marcato all’assunzione della posizione ortostatica, rendendo conto delle manifestazioni cliniche. L’anatomia ci spiega anche l’associazione tra la sindrome e la presenza di una valvola di eustachio prominente o della rete di Chiari (5), anche questi riscontrati nella nostra paziente.
In ultima analisi, la sindrome platipnea-ortodeossia rappresenta una sfida diagnostica, che necessita di un notevole sospetto clinico: la variabilità della sintomatologia correlata al decubito non è infatti ovvia e richiede un’accurata indagine anamnestica che possa sollevarne il sospetto, in particolare nelle forme di dispnea non altrimenti spiegate, come nel caso della nostra paziente in cui avevamo escluso altre cause cardiache e polmonari. Inoltre, anche le indagini effettuate risentono di una riduzione del loro potere diagnostico, dipendendo dalla posizione in cui l’esame viene eseguito, come testimoniato dalla discordanza tra l’ecocardiogramma transesofageo ed il cateterismo cardiaco eseguiti nella nostra paziente: in entrambi infatti è stato possibile il riscontro morfologico del forame ovale pervio mentre solo l’ecocardiogramma transesofageo, eseguito in virtù del sospetto clinico in decubito semiseduto, ha permesso di rilevare lo shunt destro-sinistro. Il cateterismo cardiaco escludendo la presenza di uno shunt in decubito supino, così come la presenza di ipertensione polmonare, rendeva la sindrome platipnea ortodeossia l’ultima causa possibile. Pertanto, alla luce di precedenti esperienze riportate in letteratura (7), la chiusura percutanea del PFO ha permesso un rapido miglioramento clinico della paziente. Di rilievo, dati i diversi meccanismi eziologici alla base di questa sindrome, come precedentemente illustrato, non esiste un unico trattamento valido, bensì la terapia deve essere adeguata al meccanismo sottostante.
Bibliografia
- Cheng TO (1999) Platypnea-orthodeoxia syn- drome: etiology, differential diagnosis, and management. Catheter Cardiovasc Interv 47:64–66
- Cheng TO (2002) Mechanisms of platypnea- orthodeoxia: what causes water to flow uphill? Circulation 105:e47
- Bellato V, Brusa S, Balazova J, Marescotti S, De Caria D, Bordone G (2008) Platypnea-orthodeoxia syndrome in interatrial right to left shunt postpneumonectomy. Minerva Anestesiol 74:271–275
- Rodrigues P, Palma P, Sousa-Pereira L (2012) Platypnea-orthodeoxia syndrome in review: defining a new disease? Cardiology 123:15–23
- De Vecchis R, Baldi C, Ariano C, Giasi A, Cioppa C. Platypnea-orthodeoxia syndrome : Orthostatic dyspnea and possible pathophysiological substrates. Platypnoe-Orthodeoxie-Syndrom : Orthostatische Dyspnoe und mögliche pathophysiologische Substrate. Herz. 2017;42:384-389
- Godart F, Rey C, Prat A, Vincentelli A, Chmaït A, Francart C, Porte H (2000) Atrial right-to-left shunting causing severe hypoxaemia despite normal right-sided pressures. Report of 11 consecutive cases corrected by percutaneous closure. Eur Heart J 21:483–489
- Wahl A, Windecker S, Eberli FR, et al. Percutaneous closure of patent foramen ovale in symptomatic patients.J Interv Cardiol 2001; 14: 203–209.