Una donna di 48 anni, con anamnesi cardiologica priva di eventi clinici di rilievo e fumatrice attiva, da alcune settimane lamentava riduzione della tolleranza allo sforzo con dispnea per sforzi lievi. Successivamente, in seguito a un episodio sincopale non preceduto da prodromi, si recava in Pronto Soccorso. L’elettrocardiogramma a 12 derivazioni documentava una bradicardia da ritmo atriale ectopico inferiore destro a frequenza cardiaca 35 bpm e alterazioni aspecifiche della ripolarizzazione ventricolare, mentre la radiografia del torace mostrava la presenza di grossolana formazione espansiva del mediastino (Fig. 1).

Fig. 1 – A sinistra ECG: bradicardia da ritmo atriale ectopico inferiore destro (FC 35 bpm). A destra RX del torace: grossolana formazione espansiva del mediastino.
Alla luce dell’alterazione elettrocardiografica la paziente veniva ricoverata presso il reparto di Cardiologia a Media Intensità per monitoraggio telemetrico del ritmo cardiaco e approfondimento diagnostico-terapeutico.
Come indagine di primo livello veniva eseguito ecocardiogramma transtoracico (Fig. 2) che mostrava l’ispessimento della parete libera dell’atrio destro e un nodulo iperecogeno a livello del setto interatriale. Apparivano invece normali le dimensioni, gli spessori e la cinetica bi-ventricolare, in assenza di valvulopatie.

Fig. 2 – Ecocardiogramma transtoracico: ispessimento parete libera atrio destro e nodulo iperecogeno del setto interatriale.
Lo studio della massa mediastinica veniva approfondito mediante esecuzione di TC del torace con e senza mezzo di contrasto, includendo scansioni ad alta risoluzione (HRCT) (Fig. 3). L’esame evidenziava una massa paramediastinica estesamente infiltrante entrambi gli atri, le vene polmonari superiore e destra, con enhancement a livello della vena cava superiore ed un’importante quota di versamento sia pleurico destro che pericardico in sede declive.

Fig. 3 – TC del torace sequenza post-contrastografica (a sinistra) e HRCT (a destra).
Il successivo work-up diagnostico, nel contesto di massa mediastinica con sospetto di infiltrazione a livello atriale, proseguiva con l’utilizzo di metodiche di secondo e terzo livello, quali risonanza magnetica (RM) cardiaca e tomografia a emissione di positroni/tomografia computerizzata con fluorodeossiglucosio (18F-FDG PET/TC)
La RM, successivamente, confermava l’impegno completo del setto interatriale e il coinvolgimento della vena cava superiore, del tetto dell’atrio sinistro e destro e loro parete posteriore (Fig. 4)

Fig. 4 – RM cuore sequenze T1-pesate “black blood” (in alto) e cine (in basso).
A completamento diagnostico, la 18F-FDG PET/TC evidenziava un disomogeneo iper-accumulo del radiofarmaco a livello della neoformazione pneumo-mediastinica destra (SUV max 21.1) con aree ipocaptanti contestuali come da fenomeni necrotico-colliquativi (Fig. 5).
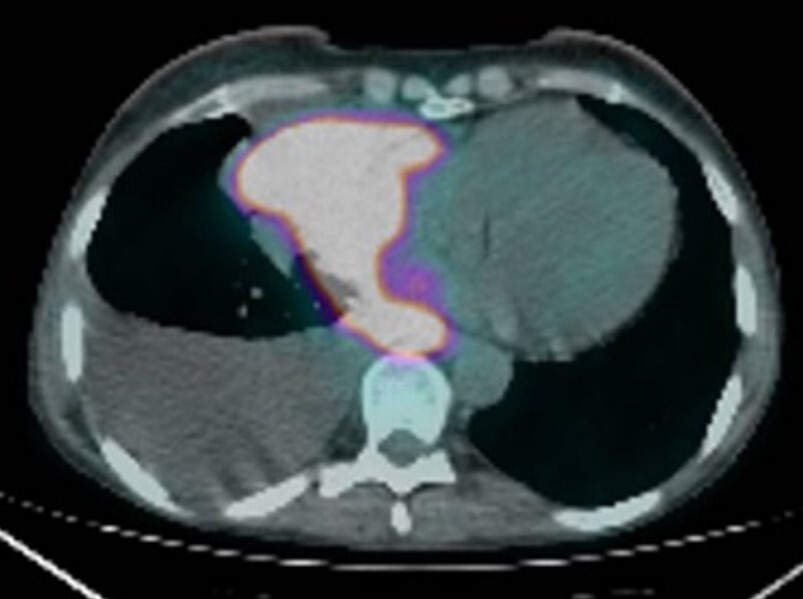
Fig. 5 – 18F-FDG PET/TC
A questo punto, l’esecuzione della biopsia effettuata in corso di fibrobroncoscopia consentiva di caratterizzare la massa dal punto di vista istologico come linfoma B diffuso a grandi cellule e di porre diagnosi di metastasi cardiaca secondaria a linfoma non Hodgkin tipo B primitivo del mediastino. Pertanto, dopo discussione collegiale con i Colleghi oncologi ed ematologi, veniva intrapresa terapia specifica con cicli settimanali di polichemioterapia.
La paziente rimaneva in osservazione cardiologica con monitoraggio elettrocardiografico in continuo e nonostante la terapia specifica, le telemetrie (Fig. 6) mostravano l’alternarsi di bradicardia sinusale, ritmo atriale ectopico, blocco seno-atriale con scappamento giunzionale e recidivanti fasi di arresto sinusale (pause fino a 8 secondi) sintomatiche per lipotimie e sincopi. Per tali episodi veniva intrapresa infusione di isoprenalina con miglioramento della conduzione ma recidive dopo sospensione della terapia.
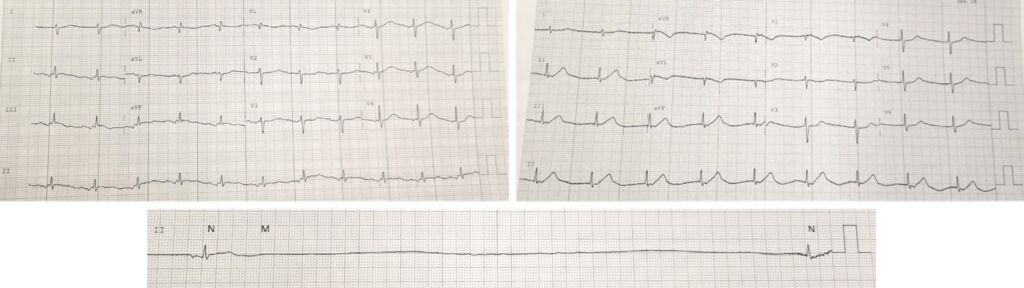
Fig. 6 – ECG. In alto a sinistra: bradicardia sinusale con ritardo di conduzione intra-atriale. In alto a destra: Blocco seno-atriale completo con ritmo di scappamento giunzionale. In basso: Arresto sinusale con pausa di 8 secondi
In considerazione delle alterazioni elettrocardiografiche evidenziate, con frequenti pause patologiche sintomatiche, veniva eseguita valutazione aritmologica che, considerando rischi e benefici, riteneva opportuno l’impianto di pacemaker definitivo (Fig. 7). La scelta ricadeva su un dispositivo leadless in quanto consentiva una minimizzazione dei rischi infettivi ed emorragici in una paziente fragile oncologica.

Fig. 7 – RX torace: riduzione della massa mediastinica dopo inizio della terapia antiblastica e impianto di PM monocamerale leadless
Conclusioni
La presentazione clinica di una massa cardiaca è estremamente eterogenea. Nel caso discusso, gli episodi sincopali e le alterazioni elettrocardiografiche evolutive si sono rivelate le manifestazioni dell’infiltrazione maligna di una neoplasia ematologica metastatica a livello di entrambi gli atri, determinando il disturbo di conduzione intra-atriale.
L’ecocardiogramma e l’impiego di metodiche di imaging di secondo (risonanza magnetica cardiaca) e terzo livello (tomografia a emissione di positroni/tomografia computerizzata), ingranaggi di un sistema complesso, hanno permesso di determinare in modo non invasivo la natura della massa cardiaca. In particolare, la risonanza magnetica viene considerata il “gold standard” non invasivo, consentendo di caratterizzare la massa dal punto di vista tissutale, vascolare e valutare l’infiltrazione delle strutture circostanti.
La PET/TC, invece, utilizza la tomografia a emissione di positroni per un’accurata valutazione dell’attività metabolica dei tumori utilizzando il 18F-FDG e, combinata con la tomografia computerizzata (18F-FDG PET/TC), rappresenta un esame fondamentale per la stadiazione della neoplasia, permettendo una più accurata localizzazione per l’esecuzione della biopsia. Tale indagine risulta anche utile nella valutazione della risposta alle terapie oncologiche.
Nonostante le valutazioni non invasive, tuttavia, l’indagine istologica rimane il fulcro decisionale per il successivo approccio terapeutico mirato.
Infine, l’indicazione a impianto di pacemaker cardiaco definitivo nel paziente con disturbi del ritmo deve tenere conto della frequenza/gravità degli eventi aritmici, del burden sintomatologico e della prognosi del singolo paziente. Per quanto riguarda pazienti affetti da neoplasie maligne, in letteratura non sono attualmente presenti pubblicazioni che comparino gli outcome di infezione, sanguinamenti e complicanze associate al pacing transvenoso rispetto ai leadless. Nel caso specifico, la scelta di impiantare un pacemaker monocamerale leadless si è basata sulla possibilità di ridurre le problematiche vascolari correlate all’utilizzo di cateteri, il rischio di embolizzazione tumorale, il rischio infettivo e l’ematoma di tasca associati alla pancitopenia secondaria alla chemioterapia.
Bibliografia
- Angeli F et al. Classificazione, caratteristiche cliniche e strategie diagnostiche delle masse cardiache. G Ital Cardiol 2022;23(8):620-630.
- Goldberg AD et al. Tumors Metastatic to the Heart. Circulation. 2013;128:1790–1794.
- Jordan JH, Todd RM, Vasu S, Hundley WG. Cardiovascular Magnetic Resonance in the Oncology Patient. JACC Cardiovasc Imaging. 2018 Aug;11(8):1150-1172.
- Tyebally S et al. Cardiac Tumors: JACC CardioOncology State-of-the-Art Review. JACC CardioOncol. 2020 Jun 16;2(2):293-311.
- Alexander R Lyon et al. ESC Guidelines on cardio-oncology: Developed by the task force on cardio-oncology of the European Society of Cardiology (ESC), European Heart Journal, Volume 43, Issue 41, 1 November 2022, Pages 4229–4361.
- Kondo S et al. Secondary Cardiac Lymphoma Presenting as Sick Sinus Syndrome and Atrial Fibrillation Which Required Leadless Pacemaker Implantation. Intern Med. 2021 Feb 1;60(3):431-434.
- Subramanyam P et al. Infiltrative Lymphoma-Associated Bradycardia and Cardiac Conduction Abnormalities. JACC CardioOncol. 2020 Mar 17;2(1):135-138.