Introduzione:
La cardiomiopatia peripartum (CMPP) è una forma di cardiomiopatia idiopatica che si sviluppa verso la fine della gravidanza o nei mesi successivi al parto o all’aborto, anche spontaneo, e che si manifesta con scompenso cardiaco a ridotta frazione di eiezione ventricolare sinistra (FE<45%), in assenza di altre cause [1]. L’incidenza della cardiomiopatia peripartum è stimata 1 su 2.230 nascite negli Stati Uniti e 1 su 1.000 nascite in tutto il mondo [2]. Le donne di origine africana e afroamericana sono a rischio più elevato di sviluppare CMPP [3], hanno prognosi peggiore e minore possibilità di recupero nonostante la terapia medica apparentemente ottimale [4]. La prognosi varia dal recupero completo della FE alla persistente riduzione della stessa, sino alla morte. La ridotta frazione d’eiezione e il ridotto accorciamento del ventricolo sinistro sono fattori prognostici negativi. Il recupero della funzione cardiaca può avvenire dopo 6 mesi, ma in alcuni casi può richiedere diversi anni [5].
La fisiopatologia della malattia non è ben chiara e sembra essere legata all’instaurarsi di uno squilibrio angiogenico in pazienti con suscettibilità genetica. Recenti evidenze affiderebbero inoltre un ruolo centrale al frammento antiangiogenico della prolattina, la 16-kDa prolattina, che sembrerebbe in grado di indurre il rilascio nel circolo sanguigno di sostanze capaci di alterare il metabolismo dei cardiomiociti e portare allo sviluppo della cardiomiopatia [1]. Dati gli effetti teratogeni di alcuni farmaci, il trattamento di questa condizione dipende dallo stato della paziente (gravidanza o meno) e si basa sulle attuali Linee guida dello scompenso cardiaco acuto e cronico. In letteratura non vi è alcuna prova che il trattamento debba essere guidato dalla sola FE [6]; la tempistica dell’impianto di defibrillatore (ICD) per la prevenzione della morte improvvisa e del trapianto cardiaco è altrettanto incerta. Le attuali evidenze suggeriscono che l’impianto di ICD debba essere eseguito se la FE non migliora entro sei mesi. Pertanto, la rivalutazione della funzione cardiaca con ecocardiografia è raccomandata ogni sei mesi.
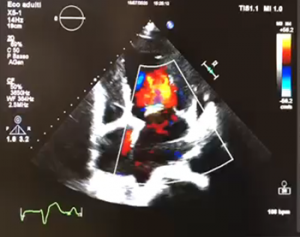
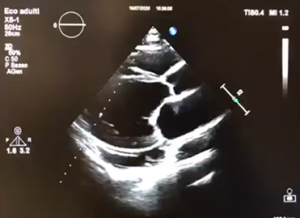
Caso clinico:
A maggio 2020, una donna africana di 47 anni affetta da cardiomiopatia peripartum con ridotta FE dal 2001, si è ricoverata presso il nostro Pronto Soccorso per appendicite. La paziente non effettuava regolari controlli cardiologici, né era aderente alla terapia medica. Alcuni giorni dopo l’intervento di appendicectomia, ha sviluppato edemi declivi e dispnea. L’ECG ha mostrato tachicardia sinusale alla FC di 100 bpm e presenza di onde T negative, la radiografia del torace ha documentato segni di congestione polmonare. La paziente è stata sottoposta ad ecocardiogramma che ha mostrato una grave riduzione della funzione sistolica globale (FE 20%), insufficienza mitralica di grado severo e rigurgito tricuspidale di grado moderato. Visto il quadro di scompenso cardiaco è stata trasferita presso il reparto di Cardiologia dove si è proceduto a coronarografia per escludere l’origine ischemica della malattia, che ha documentato coronarie esenti da stenosi angiograficamente significative. Si è giunti alla conclusione che si trattasse di un quadro di riacutizzazione di scompenso cardiaco in una paziente affetta da CMPP senza recupero della FE. Tutt’oggi la diagnosi di CMPP è una diagnosi di esclusione, dove spesso lo stato di gravidanza o il parto recente aiutano nell’individuare la malattia, nel nostro caso la storia clinica è stata determinante. Una volta esclusa la gravidanza, è stata somministrata terapia medica con diuretici per via endovenosa, beta-bloccanti, ACE-inibitori ed antagonisti del recettore dei mineralcorticoidi, insieme a supporto ventilatorio. A causa dell’eccessiva ipotensione non è stato possibile iniziare terapia con ARNI (inibitore del recettore dell’angiotensina e della neprilisina). Una volta stabilizzato il quadro clinico, la paziente è stata sottoposta ad impianto di ICD in prevenzione primaria ed è stata indirizzata ad un centro di trapianto cardiaco. Tale scelta è stata supportata dall’evidenza del mancato recupero della FE a distanza di anni.

Conclusioni
Il miglioramento della funzionalità cardiaca si verifica approssimativamente nel 50%-70% delle donne affette da CMPP sottoposte a terapia medica standard per scompenso cardiaco a ridotta FE [7]. Le pazienti che non recuperano hanno un’elevata mortalità e una prognosi negativa.
Per la gestione di tali pazienti, vista l’elevata percentuale di recupero, si è suggerito un approccio “wait and watch” con follow-up regolari e trattamenti meno aggressivi nelle prime fasi di malattia, per esempio bridge therapy con impianto di VAD in caso di shock cardiogeno, anziché il trapianto cardiaco (anche perché si è visto che questo cluster di pazienti ha maggiore mortalità e maggiore rigetto) o l’utilizzo del LifeVest, in attesa di osservare un eventuale miglioramento della funzione cardiaca.
Risulta fondamentale identificare le pazienti ad alto rischio di evoluzione in scompenso cardiaco cronico, e quindi i fattori prognostici, per programmare un attento follow-up, verificare l’aderenza alla terapia e poter scegliere il momento giusto per mettere in atto la migliore strategia terapeutica (ICD, LVAD, trapianto).
Fonti:
1. Sliwa K, Hilfiker-Kleiner D, Petrie M C, Mebazaa A, Pieske B, Buchmann E, Regitz-Zagrosek V, Schaufelberger M, Tavazzi L, van Veldhuisen D J, Watkins H, Shah A J, Seferovic P M, Elkayam U, Pankuweit S, Papp Z, Mouquet F, McMurray J J. Current state of knowledge on aetiology, diagnosis, management, and therapy of peripartum cardiomyopathy: a position statement from the Heart Failure Association of the European Society of Cardiology Working Group on peripartum cardiomyopathy. Eur J Heart Fail. 2010; 12:767–778.
2. Gary C F, Byrne J J, Nelson D B. Peripartum Cardiomyopathy. Obstetrics & Gynecology. 2019 Jan; 133(1):167-179.
3. Arany Z, Elkayam U. Peripartum Cardiomyopathy. Circulation. 2016; 133:1397-1409.
4. Irizarry O C, Levine L D, Lewey J, Boyer T, Riis V, Elovitz M A, Arany Z. Comparison of clinical characteristics and outcomes of peripartum cardiomyopathy between African American and non-African American women. JAMA Cardiol. 2017; 2:1256–1260.
5. Sliwa K, Petrie M C, Hilfiker-Kleiner D, Mebazaa A, Jackson A, Johnson M R, van der Meer P, Mbakwem A, Bauersachs J. Long-term prognosis, subsequent pregnancy, contraception and overall management of peripartum cardiomyopathy: practical guidance paper from the Heart Failure Association of the European Society of Cardiology Study Group on Peripartum Cardiomyopathy. Eur J Heart Fail. 2018 Jun; 20(6):951-962.
6. Ponikowski P, Voors A A, Anker S D, Bueno H, Cleland J G F, Coats A J S, Falk V, González-Juanatey J R, Harjola V-P, Jankowska E A, Jessup M, Linde C, Nihoyannopoulos P, Parissis J T, Pieske B, Riley J P, Rosano G M C, Ruilope L M, Ruschitzka F, Rutten F H, van der Meer P. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. European Heart Journal. 2016 Jul; 37(27):2129–2200.
7. Stergiopoulos K, Lima F. Peripartum cardiomyopathy-diagnosis, management, and long term implications. Trends in Cardiovasc Med. 2019 Apr; 29(3):164-173.
Debora Russo
Medico in formazione specialistica in Malattie dell’apparato cardiovascolare
Università degli studi di Roma Tor Vergata