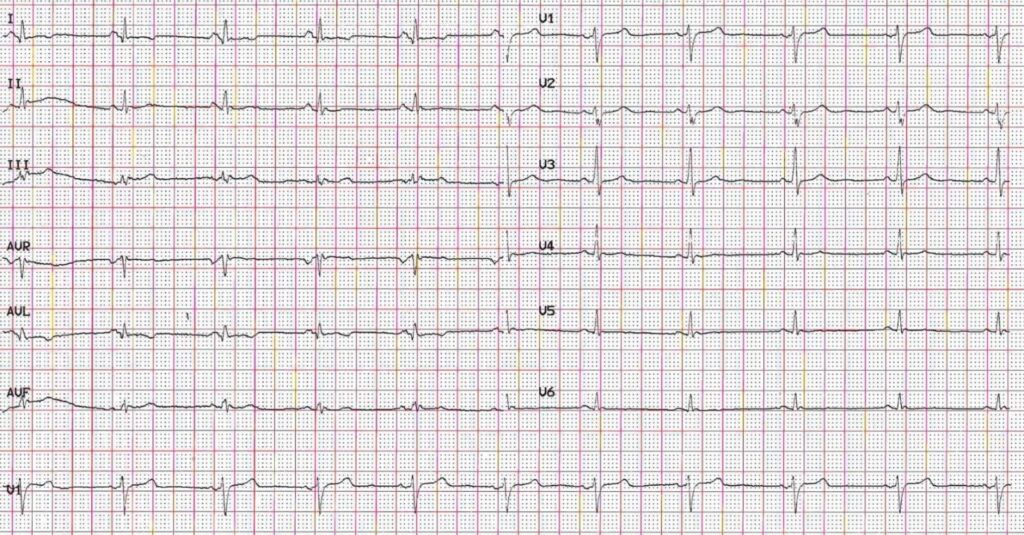
Una donna di 34 anni, senza fattori di rischio cardiovascolare né comorbidità di rilievo, giunge in Pronto Soccorso per dolore toracico oppressivo a riposo. L’ECG mostra bassi voltaggi e onde T negative nelle derivazioni laterali (Fig 1).
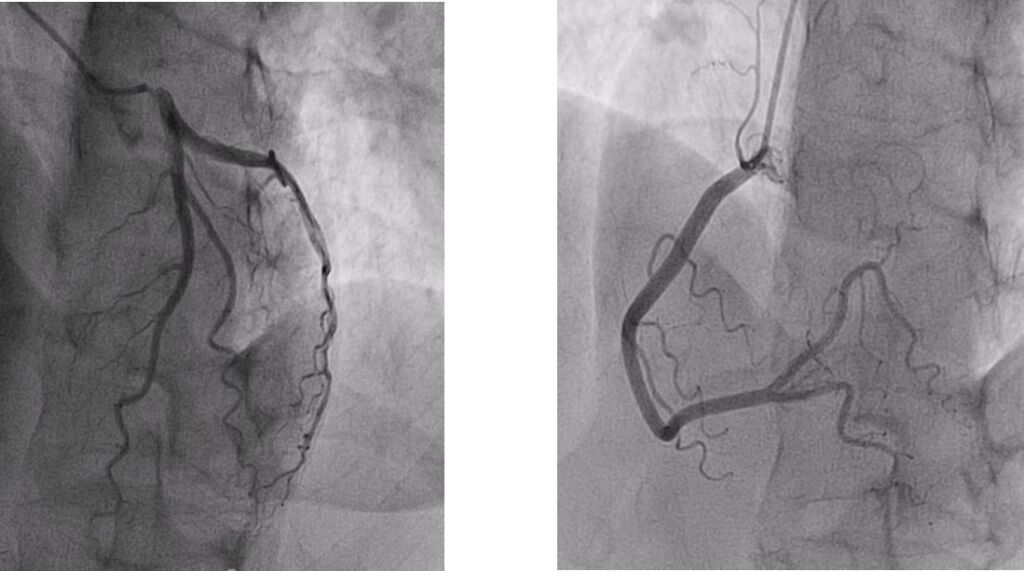
La curva della troponina è positiva per danno miocardico acuto (50 – 126 ng/L) e all’ecocardiogramma si osserva ipocinesia della parete posteriore basale del ventricolo sinistro, con una frazione di eiezione globale del 45%. Nel sospetto di sindrome coronarica acuta viene eseguita coronarografia in urgenza, con evidenza di rami epicardici angiograficamente indenni (Fig 2a e 2b).
La paziente viene dimessa con diagnosi di infarto miocardico acuto senza sopraslivellamento del tratto ST (NSTEMI) a coronarie indenni e riceve terapia di prevenzione secondaria della cardiopatia ischemica, comprendente duplice terapia antiaggregante (DAPT) per un anno (cardioASA e clopidogrel), ace inibitore, beta bloccante, statina.
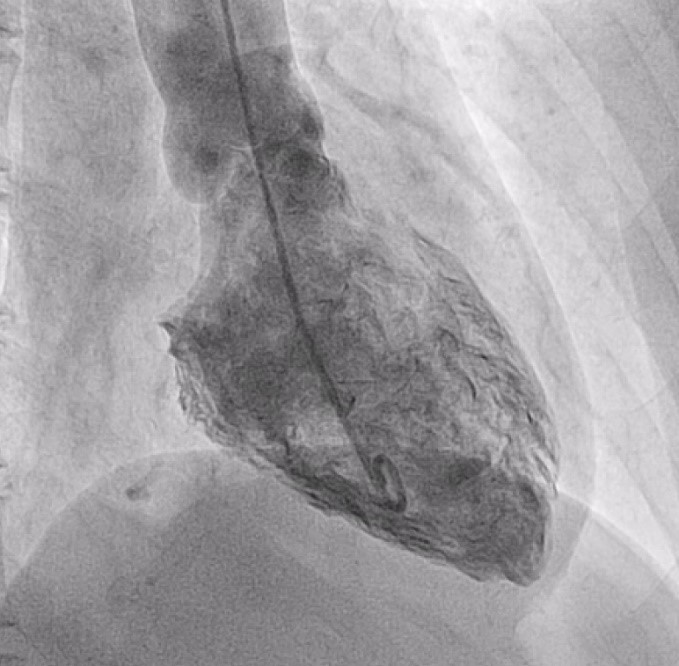
Segue periodo di benessere soggettivo, fino a cinque anni dopo, quando, in occasione di forte stress emotivo, si verifica una recidiva di dolore toracico oppressivo dalle caratteristiche analoghe al pregresso episodio. All’ECG vi sono alterazioni aspecifiche della ripolarizzazione ventricolare. Anche in questo caso la curva della troponina è positiva, tuttavia, a fronte di studio coronarografico (comprendente test funzionali di studio del microcircolo), ventricolografia (Fig 3) e screening trombofilico negativi, si pone diagnosi di recidiva di NSTEMI a coronarie indenni. Viene nuovamente prescritta (DAPT) per un anno.
Siamo nel 2020 quando si verifica un episodio sincopale a riposo preceduto da cardiopalmo aritmico. La paziente si riprende rapidamente, apparentemente senza reliquati, e allerta il Medico Curante che, a fronte anche di un riferito peggioramento della tolleranza allo sforzo (dispnea, classe funzionale NYHA II) consiglia accesso in Pronto Soccorso. I parametri vitali all’ingresso mostrano: PA 130/70 mmHg, FC 80 bpm, SpO2 99% in AA, TC 36°C. L’esame obiettivo è nella norma: non vi sono segni di scompenso cardiocircolatorio o deficit neurologici, le prove clino-ortostatismo sono negative. Agli esami ematochimici non ci sono elementi di rilievo, la troponina è < URL. L’ECG basale mostra ritmo sinusale, 2 battiti ectopici ventricolari isolati a diversa morfologia, alterazioni aspecifiche della ripolarizzazione ventricolare, bassi potenziali diffusi (Fig 4).

Figura 4: Ecg ritmo sinusale, FC 65 bpm, 2 BEV a diversa morfologia, alterazioni aspecifiche della RV.
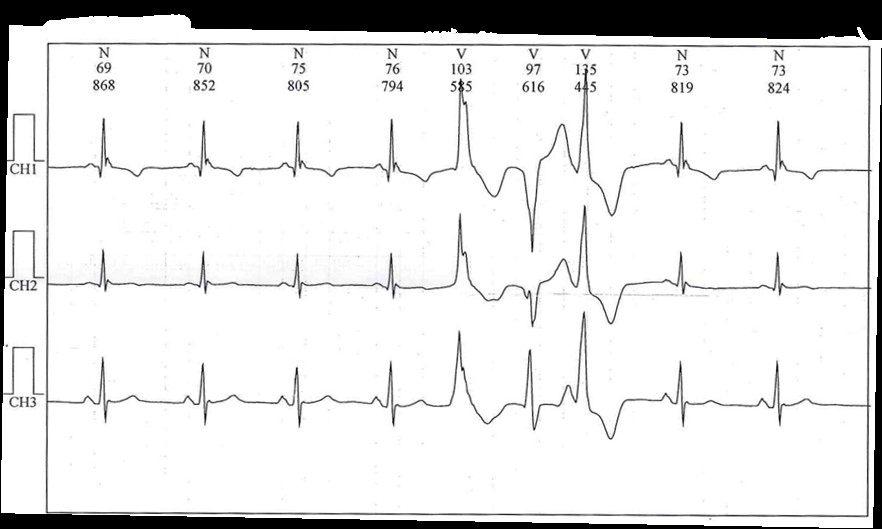
Considerando le caratteristiche dell’episodio e la storia clinica pregressa, che configurano un alto profilo di rischio complessivo, si decide per l’ospedalizzazione in ambiente monitorato. Durante il ricovero si registra frequente extrasistolia ventricolare polimorfa con coppie e triplette (totale 7569 BEV), frequente ritmo bigemino e trigemino, in assenza di pause significative (Fig. 5).
Nel work-up diagnostico vengono eseguiti anche RX torace, TC encefalo ed ecocolor Doppler dei tronchi sovraortici, negativi per elementi di rilievo.
All’ecocardiogramma si osserva una progressione del quadro rispetto ai precedenti esami: iniziale lieve dilatazione del ventricolo sinistro, acinesia del setto interventricolare (SIV) basale e ipocinesia parete inferiore medio-basale (FE complessiva stimata 37%); il ventricolo destro è nei limiti per dimensioni e cinetica sia globale che segmentaria; non vi sono valvulopatie significative.
Viene eseguita RM cardiaca, che mostra: ventricolo sinistro dilatato con ipocinesia diffusa (VTD 100 ml/m2, FE 40%); infiltrazione adiposa a livello del SIV e della parete postero-laterale; multiple aree di late gadolinium enhancement (LGE) a stria sia subepicardiche che intramiocardiche. L’esame è fortemente indicativo per cardiomiopatia aritmogena del ventricolo sinistro (Fig. 6).
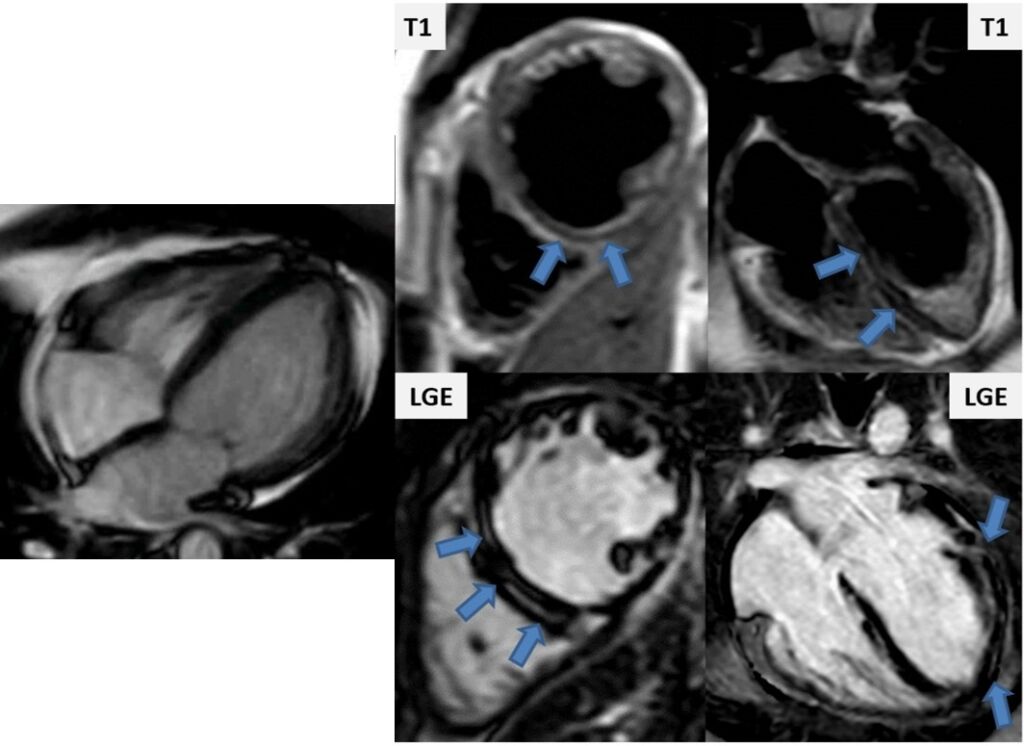
Figura 6: RM cardiaca con MdC: nel frame a sinistra si osserva iniziale dilatazione del ventricolo sinistro; nel pannello a destra invece sono riportate in alto le sequenze T1 pesate con evidenza di infiltrazione adiposa a livello del SIV e della parete postero-laterale del ventricolo sinistro (frecce), mentre in basso le sequenze di LGE con evidenza di multiple aree di wash out di MdC a carico del ventricolo sinistro (frecce).
L’analisi genetica molecolare conferma la diagnosi, risultando positiva per mutazione patogena del gene della desmoplakina (DSP), proteina fondamentale per il corretto assemblamento e funzionamento dei desmosomi.
Per una migliore stratificazione prognostica vengono eseguiti anche test da sforzo cardiopolmonare, che mostra una severa riduzione della capacità funzionale e un cateterismo cardiaco destro, che documenta normali pressioni di riempimento biventricolari e una lieve riduzione dell’indice cardiaco a riposo (2.3 L/min/m2 secondo termodiluizione).
Considerando l’evento sincopale e la presenza di malattia cardiaca strutturale, si decide di impiantare ICD in prevenzione primaria della morte improvvisa (classe IIA, livello di evidenza C secondo le linee guida della Società Europea di Cardiologia sulla diagnosi e trattamento della sincope del 2018) e viene iniziata terapia dello scompenso cardiaco, comprendente betabloccante, sacubritil/valsartan, canreonato di potassio. È in corso lo screening clinico e genetico dei familiari di primo grado (non vi sono casi accertati di morte improvvisa o cardiomiompatie), mentre la paziente viene inserita in uno stretto percorso di follow up clinico e strumentale c/o ambulatori dedicati alla gestione dello scompenso cardiaco avanzato.
Sebbene originariamente descritta come una patologia di puro interessamento del ventricolo destro, negli ultimi anni è diventato sempre più evidente come la cardiomiopatia aritmogena possa in realtà coinvolgere entrambi i ventricoli e che in alcuni pazienti interessi in maniera predominante il ventricolo sinistro1. In quest’ultimo caso la presentazione clinica è spesso caratterizzata da una spiccata componente aritmica, anche con morte cardiaca improvvisa, a prescindere dal grado di disfunzione ventricolare. Fondamentale è quindi giungere a una diagnosi precoce, processo complicato dall’assenza di interessamento ventricolare sinistro nei criteri diagnostici della Task Force internazionale del 20102. Recentemente sono stati proposti i “criteri di Padova” che individuano una serie di alterazioni morfo-funzionali (riscontrate con ECG, ecocardiogramma, RM cardiaca) da associare, nel caso di cardiomiopatia aritmogena a dominanza del ventricolo sinistro, alla mutazione patogena a carico di uno dei geni correlati al fenotipo3.
Le forme “left dominant” di cardiomiopatia aritmogena possono presentarsi con dei quadri clinici molto diversi dalle classiche forme di interessamento del ventricolo destro. Le mutazioni riguardano spesso geni desmosomiali (desmoplakina come in questo caso), ma sono coinvolti anche altri geni, come filamina C, desmina, fosfolambano. Il fenotipo caratteristico è quello di una cardiomiopatia dilatativa “mild”, con elevato substrato aritmico, familiarità per morte improvvisa, bassi potenziali all’ECG e importante quota di fibro-adiposi sostitutiva, evidenziabile alla istologia e anche alla RM4. Nelle fasi precoci della malattia, probandi e familiari si presentano spesso con “hot phases” di dolore toracico e rilascio di troponine, ricordando clinicamente delle miocarditi acute con presentazione SCA-like5 6 7.
I criteri per la stratificazione del rischio sono ancora dibattuti, ma bisogna tenere a mente che, nei pazienti che rispondono ai criteri della Task Force, l’interessamento ventricolare sinistro ha sempre identificato un sottogruppo di pazienti con prognosi peggiore, in termini soprattutto di eventi aritmici (morte improvvisa, intervento ICD, arresto cardiaco rianimato)8 9. Per di più questi casi sfuggono agli score di rischio validati per la forma classica del ventricolo destro10 , essendo questi stati validati in coorti di pazienti che presentavano principalmente mutazione a carico del gene della plakofilina 2 (PKP2), da cui i pazienti con mutazione di DSP si sono dimostrati molto diversi, in termini di interessamento spesso esclusivo del ventricolo sinistro, presentazione iniziale con dolore toracico, movimento della troponina e mancata diagnosi secondo i criteri Task Force11. Elementi che fanno propendere verso l’impianto di ICD in prevenzione primaria sono rappresentati, oltre che dal grado di disfunzione ventricolare sinistra e dal riscontro di aritmie al monitoraggio Holter periodico, anche dall’estensione della fibro-adiposi evidenziata alla RM e dalla forte familiarità per morte improvvisa.
In conclusione, questo è un caso emblematico di cardiomiopatia aritmogena del ventricolo sinistro, sottolinea come MINOCA (Myocardial Infarction in Non-Obstructive Coronary Artery disease) e «miocardite acuta» possano in realtà nascondere la diagnosi di una condizione geneticamente determinata e ricorda l’assoluta necessità di eseguire, in queste situazioni, RM cardiaca come imaging di primo livello, per evitare ritardo diagnostico ed eseguire screening familiare.
BIBLIOGRAFIA
1. Sean-Chowdry S, Syrris P, Prasad SK, et al. Left-dominant arrhythmogenic cardiomyopathy: an under-recognized clinical entity. J Am Coll Cardiol. 2008;52(25):2175-2187. doi:10.1016/J.JACC.2008.09.019
2. Marcus FI, McKenna WJ, Sherrill D, et al. Diagnosis of Arrhythmogenic Right Ventricular Cardiomyopathy/Dysplasia. Circulation. 2010;121(13):1533-1541. doi:10.1161/CIRCULATIONAHA.108.840827
3. Corrado D, Marra MP, Zorzi A, et al. Diagnosis of arrhythmogenic cardiomyopathy: The Padua criteria. Int J Cardiol. 2020;319:106-114. doi:10.1016/J.IJCARD.2020.06.005
4. Miles C, Finocchiaro G, Papadakis M, et al. Sudden Death and Left Ventricular Involvement in Arrhythmogenic Cardiomyopathy. Circulation. 2019;139(15):1786-1797. doi:10.1161/CIRCULATIONAHA.118.037230
5. Piriou ED, Marteau L, Kyndt, et al. Familial screening in case of acute myocarditis reveals inherited arrhythmogenic left ventricular cardiomyopathies. ESC Hear Fail. 2020;7(4):1520-1533. doi:10.1002/EHF2.12686
6. Bariani R, Cipriani A, Rizzo S, et al. ‘Hot phase’ clinical presentation in arrhythmogenic cardiomyopathy. Europace. 2021;23(6):907-917. doi:10.1093/EUROPACE/EUAA343
7. Garcia-Pavia P, Syrris P, Salas C, et al. Desmosomal protein gene mutations in patients with idiopathic dilated cardiomyopathy undergoing cardiac transplantation: a clinicopathological study. Heart. 2011;97(21):1744-1752. doi:10.1136/HRT.2011.227967
8. Aquaro GD, De Luca A, Cappelletto C, et al. Prognostic Value of Magnetic Resonance Phenotype in Patients With Arrhythmogenic Right Ventricular Cardiomyopathy. J Am Coll Cardiol. 2020;75(22):2753-2765. doi:10.1016/J.JACC.2020.04.023
9. Cipriani A, Barbara B, De Lazzari M, et al. Arrhythmogenic Right Ventricular Cardiomyopathy: Characterization of Left Ventricular Phenotype and Differential Diagnosis With Dilated Cardiomyopathy. J Am Heart Assoc. 2020;9(5). doi:10.1161/JAHA.119.014628
10. Protonotarios A, Elliott PM. Arrhythmogenic cardiomyopathies (ACs): diagnosis, risk stratification and management. Heart. 2019;105(14):1117-1128. doi:10.1136/HEARTJNL-2017-311160
11. Smith ED, Lakdawala NK, Papoutsidakis N, et al. Desmoplakin Cardiomyopathy, a Fibrotic and Inflammatory Form of Cardiomyopathy Distinct from Typical Dilated or Arrhythmogenic Right Ventricular Cardiomyopathy. Circulation. 2020;141(23):1872-1884. doi:10.1161/CIRCULATIONAHA.119.044934