Introduzione
Il Sars-CoV-2 (Severe acute respiratory syndrome-CoronaVirus-2) provoca un danno diretto sulle cellule endoteliali ed è responsabile di una vera e propria endotelite, sostenuta anche dalla tempesta di citochine pro-infiammatorie che si liberano a seguito dell’infezione 1. La disfunzione endoteliale che ne consegue, determinando instabilità e possibile rottura delle placche aterosclerotiche, è alla base del milieu trombotico che rappresenta una delle caratteristiche cardine della malattia da coronavirus 2019 (COVID-19). Tuttavia, l’elevata attivazione piastrinica, le alterazioni a carico della cascata della coagulazione e lo sviluppo di trappole extracellulari neutrofiliche possono risultare nella formazione di trombi arteriosi anche in assenza di aterosclerosi 2–4. I riscontri autoptici di pazienti con COVID-19 mostrano una tipica deposizione trombotica ricca di piastrine, fibrina e megacariociti a livello del microcircolo, prevalentemente polmonare ma anche di altri organi, tra cui in particolare il cuore, nonostante una coesistente terapia antitrombotica 5. Il coinvolgimento del sistema cardiovascolare si può manifestare come miocardite, cardiomiopatia da stress, fenomeni tromboembolici venosi e danno miocardico su base vascolare, situazioni che si presentano con sintomatologia sovrapponibile, rendendo la diagnosi definitiva spesso difficile 6. Sebbene la trombosi arteriosa coronarica rappresenti la causa principale di infarto miocardico acuto con sopraslivellamento del tratto ST (STEMI) nei pazienti con COVID-19, alcune case series hanno riportato un’elevata incidenza di coronarie prive di stenosi 7,8, condizione che potrebbe essere spiegata sia dalla severa ipossiemia spesso presente in questi pazienti, sia da una trombosi diffusa del microcircolo e/o delle vene miocardiche 5,9.
Presentazione del caso
Un paziente maschio di 55 anni è stato portato in emergenza presso il Pronto Soccorso (PS) del nostro Ospedale dopo un arresto cardio-respiratorio causato da tre episodi subentranti di fibrillazione ventricolare (FV), prontamente riconosciuti e rapidamente trattati con DC-shock. Il paziente si trovava in una struttura vicina alla nostra Istituzione, dove stava conducendo un programma di riabilitazione dopo esser stato ricoverato due settimane prima per una polmonite bilaterale da Sars-CoV-2. La polmonite era in fase di remissione, ma ancora presente e in terapia con ossigeno nasale a bassi flussi, terapia corticosteroidea ed eparina a basso peso molecolare. Tra le comorbidità del paziente, si annoverano la presenza di diabete mellito di tipo 2 in terapia insulinica, ipotiroidismo in trattamento ormonale sostitutivo e disturbo bipolare controllato da litio.
All’arrivo in PS il paziente è vigile (Glasgow Coma Scale [GCS] 15), emodinamicamente stabile (pressione arteriosa 110/70 mmHg) e tachipnoico seppur con scambi respiratori conservati in maschera semplice (frequenza respiratoria 24 atti/minuto, Sp02 98%). L’ecocardiogramma transtoracico evidenzia una grave disfunzione biventricolare (frazione di eiezione ventricolare sinistra 25%, escursione sistolica del piano dell’anello tricuspidalico [TAPSE] 11 mm) e un’acinesia di tutta la parete inferiore e infero-laterale. Uno stato di instabilità aritmica si sviluppa pochi minuti dopo l’ammissione, con episodi subentranti di torsione di punta e FV, che vengono immediatamente trattati con DC-shock con ritorno allo stato di circolazione spontanea (ROSC). Pertanto, vengono somministrati i seguenti antiaritmici per via endovenosa: 2 grammi di magnesio solfato, una dose di carico di amiodarone (300 mg) e boli ripetuti di lidocaina (dose totale 200 mg) ed esmololo (dose totale 50 mg).
Diagnosi differenziale dell’arresto cardio-respiratorio (ACR)
Qual è la causa più probabile dello storm aritmico e del conseguente ACR? Considerata l’infezione da Sars-Cov-2, le due possibilità diagnostiche che possono essere ipotizzate sono l’embolia polmonare e la miocardite fulminante, la prima tuttavia poco plausibile dato il quadro di instabilità aritmica piuttosto che emodinamica e la seconda un’evenienza possibile ma alquanto rara. Gli episodi di torsione di punta potrebbero anche essere causati da un allungamento del QT secondario alla terapia con litio.
La Figura 1 mostra l’elettrocardiogramma del paziente e definisce in modo chiaro la causa scatenante il quadro clinico del paziente: un infarto miocardico acuto con sopraslivellamento del tratto ST (STEMI) in corso di fibrillazione atriale.

Gestione del caso
Il paziente viene trasportato in sala di emodinamica, dove viene sottoposto a una coronarografia in emergenza, eseguita tramite accesso femorale destro, che mostra un’occlusione trombotica acuta della coronaria destra (Cdx) al tratto prossimale con flusso TIMI (Thrombolysis In Myocardial Infarction) 0. L’angiografia della coronaria sinistra mette in evidenza un’occlusione simultanea del ramo interventricolare anteriore (IVA) prossimale da trombosi endoluminale in assenza di aterosclerosi coronarica con flusso TIMI 0. Considerato l’elevato carico trombotico, viene deciso di effettuare la trombectomia reolitica con sistema AngioJet (Boston Scientific, Marlborough, MA, USA) sulla coronaria destra, senza ottenere alcun beneficio.
Nel frattempo, viene iniziata la terapia antiaggregante con somministrazione endovenosa di acido acetilsalicilico (250 mg), cangrelor (dose di carico e mantenimento secondo peso corporeo) ed eptifibatide intracoronarico (secondo peso corporeo), solo con una minima riduzione carico trombotico. Per la comparsa di un ulteriore episodio di FV, prontamente trattato con DC-shock e immediato ROSC, viene iniziata lidocaina in infusione continua (40 mg/kg/min) e, data la contemporanea presenza di marcata bradicardia, viene posizionato un pacemaker temporaneo in ventricolo destro tramite accesso venoso femorale destro. Inoltre, per un peggioramento anche del quadro emodinamico, viene iniziata noradrenalina (fino a 1 mg/kg/min) e inserito un contropulsatore aortico.
Dopo tali manovre, e passati 10-20 minuti dall’inizio della procedura, la situazione non è cambiata. Viene quindi deciso di effettuare anche la trombectomia reolitica sull’IVA, senza ottenere alcun beneficio anche a questo livello. Nel frattempo, però, il paziente diventa non responsivo con GCS 3, rendendo necessaria l’intubazione oro-tracheale. Viene eseguita un’angiografia cerebrale da entrambe le carotidi che esclude un’occlusione arteriosa acuta dei rami cerebrali (Figura 2).

Data la completa inefficacia sia della trombectomia reolitica che della terapia antitrombotica farmacologica, viene scelto di utilizzare un sistema neurovascolare di tromboaspirazione (Penumbra, Alameda, CA, USA) per la sua capacità specifica di rimuovere trombi di grandi dimensioni. Vengono quindi effettuati numerosi passaggi nella coronaria destra, ottenendo l’estrazione di un trombo a stampo (Figura 3) e il ripristino del flusso anterogrado dopo più di un’ora di procedura.

Per ridurre ulteriormente il carico trombotico a livello della coronaria destra distale, laddove il catetere Penumbra non è in grado di arrivare, viene eseguito anche un passaggio con un catetere da tromboaspirazione meccanica (Export Advance, Medtronic, Minneapolis, MN, USA). Per la persistenza di trombo prevalentemente al termine del secondo tratto e al terzo tratto di Cdx, viene impiantato uno stent ricoperto di poliuretano di ultima generazione 4.0×24 mm (BeGraft, Bentley InnoMed GmbH, Hechingen, Germania) al termine del secondo tratto (Figura 4) e uno stent al rilascio di everolimus 3.5×48 mm al terzo tratto di Cdx verso il ramo posterolaterale (Figura 5). L’angiografia della coronaria destra mostra un ottimo risultato finale, con flusso TIMI 3 e minima persistenza di trombosi solo sul ramo interventricolare posteriore.
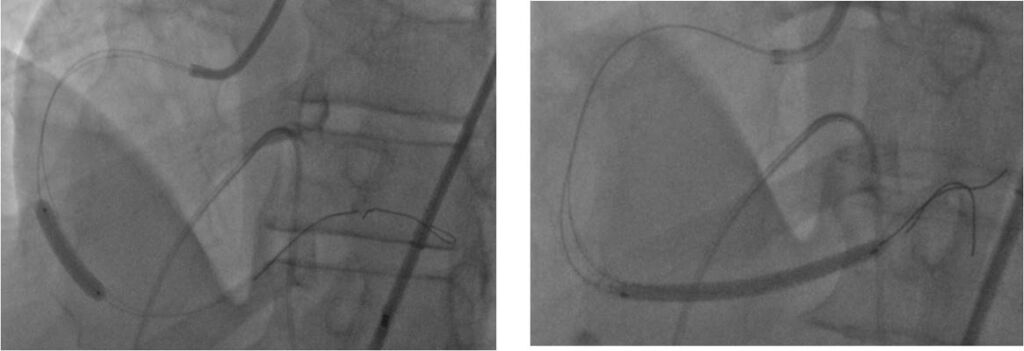
L’IVA, parzialmente ricanalizzata dal trattamento farmacologico, viene trattata con l’impianto, al tratto prossimale, di uno stent al rilascio di everolimus 3.5×33 mm, ottenendo anche a questo livello un ottimo risultato angiografico finale con flusso TIMI.
Discussione
I pazienti con COVID-19 che sviluppano uno STEMI hanno una prognosi notevolmente peggiore rispetto ai pazienti che non hanno un’infezione da Sars-CoV-2. L’associazione di queste due condizioni cliniche, infatti, determina un aumento della mortalità, sia cardiovascolare che per tutte le cause, degli eventi cardiovascolari acuti maggiori (MACE) e di ictus cerebrale 10–12. I pazienti con COVID-19 e STEMI, rispetto alla controparte non-COVID-19, hanno inoltre una presentazione clinica più grave, con maggior probabilità di arresto 13, scompenso cardiaco e shock cardiogeno, sia all’ammissione che dopo l’angioplastica 10,11. Lo stato di ipercoagulabiltà è probabilmente responsabile della peggiore prognosi, determinando infatti una maggiore incidenza di trombosi intrastent, multivasale e di grado elevato 10,13.
L’utilizzo di sistemi di tromboaspirazione convenzionali, assieme a una terapia farmacologica antitrombotica massimale, talvolta non è sufficiente a risolvere l’elevato carico trombotico che caratterizza questo gruppo di pazienti 14,15. Nelle linee guida della Società Europea di Cardiologia (ESC) del 2017 sullo STEMI, l’utilizzo dei cateteri da tromboaspirazione è controindicato come strategia di routine (classe di raccomandazione III, livello di evidenza A), ma può essere considerato nei casi con elevato carico trombotico residuo dopo aver riaperto il vaso con un filoguida o un palloncino da angioplastica. Tali raccomandazioni si basano sull’evidenza che l’utilizzo routinario della tromboaspirazione non migliora gli outcome clinici 16 e si associa a un maggior rischio di stroke nei pazienti con elevato carico trombotico coronarico 17 (grado di trombosi TIMI >3), seppure si associ a una riduzione della mortalità cardiovascolare 18. I cateteri da tromboaspirazione coronarica convenzionale, tuttavia, non consentono la rimozione completa di trombi ben organizzati; il sistema Penumbra è stato sviluppato, invece, per l’utilizzo nei pazienti con ictus ischemico causato dall’occlusione acuta di grossi vasi intracranici, che a sua volta è spesso determinata dall’embolizzazione di trombi ben organizzati formatisi nell’appendice atriale sinistra in corso di fibrillazione atriale. Per tale motivo, può rappresentare la migliore opzione in casi di trombi coronarici ben organizzati, indipendentemente dalla causa scatenante. Una volta ottenuto un ripristino del flusso anterogrado ma con la persistenza di un elevato carico trombotico, l’impianto di uno stent ricoperto consente di escludere e sigillare il trombo e, sebbene non siano ancora del tutto noti gli outcome a lungo termine, gli stent ricoperti di seconda generazione, grazie all’evoluzione tecnica e alla maggiore facilità di impiego rispetto a quelli di prima generazione, sono una strategia di salvataggio utile in casi di trombosi refrattaria 19,20.
La caratteristica peculiare di questo caso è l’occlusione trombotica acuta simultanea della coronaria destra prossimale e del ramo interventricolare anteriore prossimale. Lo stato di ipercoagulabilità e la disfunzione endoteliale che si associano all’infezione da Sars-CoV-2 potrebbero rappresentare la causa della trombosi multivasale in assenza di malattia aterosclerotica coronarica, ma non è possibile escludere anche un’embolizzazione da fibrillazione atriale, considerato il ritmo di presentazione del paziente.
Conclusioni
I pazienti con COVID-19 possono sviluppare un’occlusione coronarica acuta con un elevato carico trombotico anche in assenza di aterosclerosi coronarica e hanno spesso una presentazione più grave e una prognosi peggiore dei pazienti che non hanno un’infezione da Sars-CoV-2.
Il sistema di riperfusione Penumbra rappresenta una strategia bail-out utile ed efficace in casi con un elevato carico trombotico refrattario ai cateteri da tromboaspirazione convenzionale e alle terapie farmacologiche antitrombotiche.
Bibliografia
1. Varga Z, Flammer AJ, Steiger P, et al. Endothelial cell infection and endotheliitis in COVID-19. The Lancet. 2020;395(10234). doi:10.1016/S0140-6736(20)30937-5
2. Kirresh A, Coghlan G, Candilio L. COVID-19 Infection and High Intracoronary Thrombus Burden. Cardiovascular Revascularization Medicine. 2021;28. doi:10.1016/j.carrev.2020.07.032
3. Levi M, Thachil J, Iba T, Levy JH. Coagulation abnormalities and thrombosis in patients with COVID-19. The Lancet Haematology. 2020;7(6). doi:10.1016/S2352-3026(20)30145-9
4. Blasco A, Coronado MJ, Hernández-Terciado F, et al. Assessment of Neutrophil Extracellular Traps in Coronary Thrombus of a Case Series of Patients with COVID-19 and Myocardial Infarction. JAMA Cardiology. 2021;6(4). doi:10.1001/jamacardio.2020.7308
5. Rapkiewicz A v., Mai X, Carsons SE, et al. Megakaryocytes and platelet-fibrin thrombi characterize multi-organ thrombosis at autopsy in COVID-19: A case series. EClinicalMedicine. 2020;24. doi:10.1016/j.eclinm.2020.100434
6. Kornowski R, Orvin K. The Clinical Challenge of ST-Segment Elevation Myocardial Infarction and COVID-19. Journal of the American College of Cardiology. 2021;77(16). doi:10.1016/j.jacc.2021.03.231
7. Bangalore S, Sharma A, Slotwiner A, et al. ST-Segment Elevation in Patients with Covid-19 — A Case Series. New England Journal of Medicine. 2020;382(25). doi:10.1056/nejmc2009020
8. Stefanini GG, Montorfano M, Trabattoni D, et al. ST-Elevation myocardial infarction in patients with COVID-19: Clinical and angiographic outcomes. Circulation. 2020;141(25). doi:10.1161/CIRCULATIONAHA.120.047525
9. Guagliumi G, Sonzogni A, Pescetelli I, Pellegrini D, Finn A v. Microthrombi and ST-Segment-Elevation Myocardial Infarction in COVID-19. Circulation. Published online 2020. doi:10.1161/CIRCULATIONAHA.120.049294
10. Rodriguez-Leor O, Cid-Alvarez B, de Prado AP, et al. In-hospital outcomes of COVID-19 ST-elevation myocardial infarction patients. EuroIntervention. 2021;16(17). doi:10.4244/EIJ-D-20-00935
11. Garcia S, Dehghani P, Grines C, et al. Initial Findings From the North American COVID-19 Myocardial Infarction Registry. Journal of the American College of Cardiology. 2021;77(16). doi:10.1016/j.jacc.2021.02.055
12. Saad M, Kennedy KF, Imran H, et al. Association between COVID-19 Diagnosis and In-Hospital Mortality in Patients Hospitalized with ST-Segment Elevation Myocardial Infarction. JAMA – Journal of the American Medical Association. 2021;326(19):1940-1952. doi:10.1001/jama.2021.18890
13. Choudry FA, Hamshere SM, Rathod KS, et al. High Thrombus Burden in Patients With COVID-19 Presenting With ST-Segment Elevation Myocardial Infarction. Journal of the American College of Cardiology. 2020;76(10). doi:10.1016/j.jacc.2020.07.022
14. Seif S, Ayuna A, Kumar A, Macdonald J. Massive coronary thrombosis caused primary percutaneous coronary intervention to fail in a COVID-19 patient with ST-elevation myocardial infarction. Catheterization and Cardiovascular Interventions. 2021;97(5). doi:10.1002/ccd.29050
15. Tedeschi D, Rizzi A, Biscaglia S, Tumscitz C. Acute myocardial infarction and large coronary thrombosis in a patient with COVID-19. Catheterization and Cardiovascular Interventions. 2021;97(2). doi:10.1002/ccd.29179
16. Fröbert O, Lagerqvist B, Olivecrona GK, et al. Thrombus Aspiration during ST-Segment Elevation Myocardial Infarction. http://dx.doi.org/101056/NEJMoa1308789. 2013;369(17):1587-1597. doi:10.1056/NEJMOA1308789
17. Jolly SS, Cairns JA, Lavi S, et al. Thrombus Aspiration in Patients With High Thrombus Burden in the TOTAL Trial. Journal of the American College of Cardiology. 2018;72(14):1589-1596. doi:10.1016/J.JACC.2018.07.047
18. Jolly SS, James S, Džavík V, et al. Thrombus Aspiration in ST-Segment-Elevation Myocardial Infarction: An Individual Patient Meta-Analysis: Thrombectomy Trialists Collaboration. Circulation. 2017;135(2):143-152. doi:10.1161/CIRCULATIONAHA.116.025371
19. di Mario C, Ciardetti N, Demola P. Second Generation: Better Also for Covered Stents? Cardiovascular Revascularization Medicine. 2021;29. doi:10.1016/j.carrev.2021.06.011
20. Gunn J, Siotia A, Malkin CJ, Iqbal J, Raina T, Morton AC. Novel use of a pericardium-covered stent graft to treat bulky coronary artery thrombus. Catheterization and Cardiovascular Interventions. 2012;80(1). doi:10.1002/ccd.23184