Un ragazzo di 39 anni accede in pronto soccorso per dispnea severa associata a febbre con brivido. Analizzando i sintomi, il paziente riferisce che le difficoltà respiratorie sono insorte da un mese e che sono progressivamente evolute da lieve a severe, tanto da andare a limitare le normali attività quotidiane.
Dal punto di vista della storia familiare, la madre risulta affetta da cardiomiopatia dilatativa ed il precedente screening cardiologico effettuato sul ragazzo è sempre risultato nei limiti1.
Il paziente si presenta apiretico, con parametri vitali nei limiti (PA 110/75 mmHg, SatO2 96% in aria ambiente) e l’elettrocardiogramma risulta normale per ritmo e morfologia, seppure sia presente una lieve tachicardia.
Nel sospetto iniziale di embolia polmonare viene effettuata angio-TC del torace con esito negativo ma che mostra un quadro interstiziale dubbio (Figura 1).

Vengono quindi eseguiti tampone e successivo lavaggio bronchiolo-alveolare (BAL) per SARS-CoV2, risultati negativi. Agli esami ematochimici si rileva una leucocitosi neutrofila con presenza di leucociti all’esame microscopico delle urine.
In relazione alla storia familiare viene quindi eseguito un controllo ecocardiografico con rilievo di marcata dilatazione del ventricolo sinistro (DTD 78mm) con severa disfunzione (FE 20%) per ipocinesia diffusa in assenza di ipertensione polmonare (Figura 2).

A questo punto viene predisposto il trasferimento in cardiologia dove viene impostata terapia con beta-bloccante (bisoprololo 1.25mgx2/die), con diuretico risparmiatore di potassio (canrenoato 25mg/die) e con diuretico dell’ansa, in relazione al quadro di severa disfunzione ventricolare sinistra. Viene inoltre inserita terapia antibiotica empirica (ceftriaxone 1gr/die) per il sospetto quadro infettivo a partenza dalle vie urinarie. A causa dei bassi valori pressori (PA 100/50mmHg), viene per il momento rimandata l’introduzione di un ACE-inibitore/ARB.
Il pomeriggio stesso, in considerazione del quadro cardiologico, si opta per il trasferimento del paziente in terapia sub-intensiva dove viene posizionato un monitoraggio pressorio invasivo mediante catetere arterioso radiale destro.
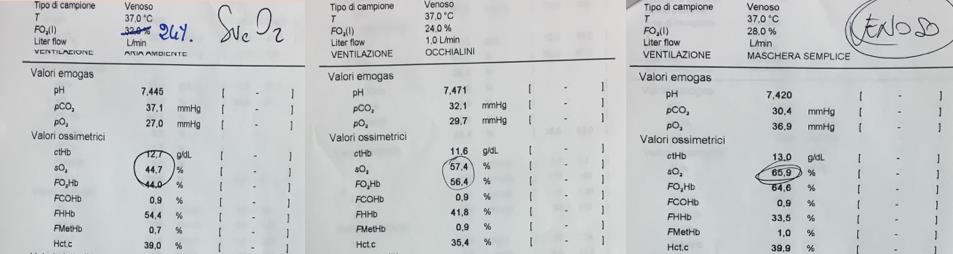
La pressione arteriosa risulta di 100/55 mmHg (PAM 70 mmHg) e l’EGA arterioso riporta i seguenti valori: PH 7.44, pCO2 28 mmHg, pO2 68 mmHg, SatO2 94%, lac 2.3 mmol/L, HCO3 – 18 mmol/L, BE -5.
Viene impostata quindi O2 terapia con occhialini nasali (2 l/min), in considerazione del quadro di ipossia relativa (la PaO2 attesa per l’età del paziente è 90mmHg).
Al fine di escludere l’ipotesi diagnostica di miocardite acuta/subacuta nel sospetto principale di cardiomiopatia dilatativa familiare, si richiede Risonanza Magnetica Cardiaca2,3.
Il mattino seguente, durante i preparativi per il trasporto in radiologia, si assiste ad un severo episodio ipotensivo (PA 85/50mmHg, PAM 63mmHg) associato a diaforesi profusa nel passaggio da clino ad ortostatismo. Viene quindi eseguito un rapido reintegro volemico con cristalloidi ed iniziata terapia con noradrenalina ev (0.05 γ/kg/min).
Il controllo ecocardiografico successivo mostra diffusa e marcata ipocinesia del ventricolo sinistro con funzione globale severamente depressa (FE 10%) associata a rigurgito mitralico severo (Figura 3).
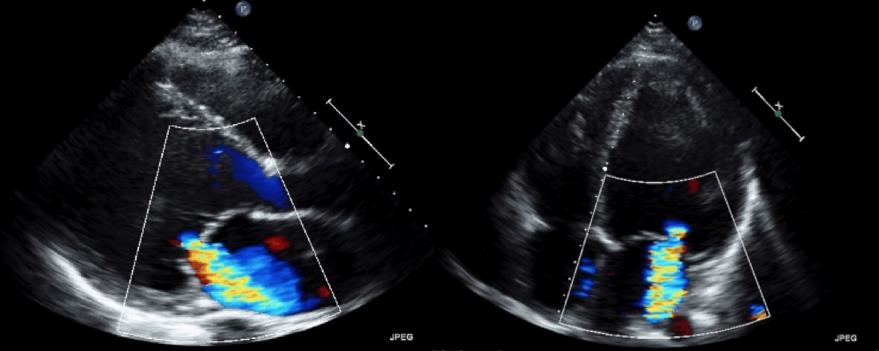
Il paziente si presenta madido e pallido, tendenzialmente ipoteso nonostante noradrenalina. All’emogasanalisi si riscontra alcalosi respiratoria compensatoria senza significativo rifornimento di lattati: PH 7.5, pCO2 27 mmHg, pO2 105 mmHg, Lac 1.8 mmol/L, BE -2.
Siamo di fronte ad un quadro di “impending shock”.
Si opta quindi per il rapido trasferimento del paziente in terapia intensiva cardiologica dove viene posizionato un catetere venoso centrale eco-guidato in giugulare interna destra per consentire l’inizio della terapia inotropa con dobutamina 3.5 γ/Kg/min associata a noradrenalina 0.1 γ/kg/min. Viene inoltre incrementato il dosaggio di diuretico dell’ansa, ora in infusione continua.
Nel tentativo di monitorare la diuresi, si eseguono multipli tentativi di posizionamento di catetere che risultano traumatici ed inefficaci, a causa dell’aspetto bifido del meato uretrale esterno. Dopo valutazione urologica, viene effettuata una epicistostomia transcutanea ecoguidata.
La situazione si aggrava ulteriormente nel pomeriggio per il ripresentarsi di febbre associata a brivido scuotente (TC 38.5°C) per cui, nonostante venga modificata la terapia antibiotica empirica (iniziata infusione di meropenem e vancomicina in attesa degli esami colturali), si assiste ad un ulteriore peggioramento delle condizioni cliniche del paziente, attualmente in terapia con noradrenalina e dobutamina ad alta dose (Parametri vitali: PA 100/50mmHg con PAM 67mmHg, RS 130bpm. ScvO2 44%).
Rapidamente viene eseguito un ulteriore controllo ecocardiografico che mostra dilatazione e disfunzione del ventricolo sinistro, sovrapponibili al controllo precedente, con un quadro di iniziale failure del ventricolo destro, che si presenta dilatato ed ipocinetico (RVD1 48mm, TAPSE 10mm) nonostante il supporto inotropo (Figura 4)4.

Viene dunque deciso di sostituire dobutamina con adrenalina e di posizionare un Contropulsatore Aortico in modalità 1:1 a letto del paziente mediante accesso arterioso femorale destro5 (Figura 5 A). Vengono inoltre posizionati un catetere bilume per dialisi in vena femorale sinistra, un introduttore arterioso 6 fr in arteria femorale sinistra ed un introduttore venoso 7 fr in vena femorale destra da utilizzare in caso di necessità di upgrading del supporto meccanico ad ECMO Veno-Arterioso6 (Figura 5 C). Viene poi iniziata emodiafiltrazione veno-venosa continua (CVVHDF) con sistema Prismaflex attraverso il catetere bilume.

Il supporto meccanico, associato all’ottimizzazione del supporto inotropo (noradrenalina 0.2 γ/Kg/min associata ad adrenalina 0.07 γ/Kg/min) e alla terapia sostitutiva renale, determina immediatamente un miglioramento delle condizioni emodinamiche del paziente, confermato dai parametri emogasanalitici e di perfusione (ScvO2 65%, Figura 6).
Il repentino peggioramento delle condizioni cliniche del paziente è interpretabile come una sovrammissione di shock settico e cardiogeno che ha portato ad uno stato di severa instabilità emodinamica ed alla necessità di utilizzare un supporto meccanico al circolo. Fortunatamente non è stato necessario il posizionamento di un sistema di circolazione extracorporea (ECMO Veno-Arterioso) per il miglioramento successivo dello stato circolatorio del paziente.
Il giorno seguente infatti si presenta eupnoico, lucido e collaborante. Non sono più presenti segni obiettivi di ipoperfusione e la frequenza cardiaca si è normalizzata (FC 90 bpm).
Ottenuta con fatica la stabilità emodinamica, il caso viene discusso collegialmente con il centro trapianti di riferimento (Ospedale Santa Maria alle Scotte, Siena) e viene concordato il trasferimento urgente.
Presso l’ospedale di Siena si esegue switch da IABP ad Impella 5.0 (Figura 5 B), con finalità bridge to transplant7, e si procede ad una richiesta d’organo in regime di emergenza nazionale. Viene inoltre eseguita valutazione urologica con rilievo di fistola uretrale condizionante il quadro settico. Alla risoluzione del quadro infettivo, viene eseguito intervento di trapianto cardiaco con decorso postoperatorio privo di complicanze.
BIBLIOGRAFIA
1. McNally EM, Mestroni L. Dilated cardiomyopathy: Genetic determinants and mechanisms. Circ Res. 2017;121(7):731-748. doi:10.1161/CIRCRESAHA.116.309396
2. Ammirati E, Frigerio M, Adler ED, et al. Management of Acute Myocarditis and Chronic Inflammatory Cardiomyopathy: An Expert Consensus Document. Circ Hear Fail. 2020;(November):663-687. doi:10.1161/CIRCHEARTFAILURE.120.007405
3. Ammirati E, Veronese G, Brambatti M, et al. Fulminant Versus Acute Nonfulminant Myocarditis in Patients With Left Ventricular Systolic Dysfunction. J Am Coll Cardiol. 2019;74(3):299-311. doi:10.1016/j.jacc.2019.04.063
4. Grant C, Richards JB, Frakes M, Cohen J, Wilcox SR. ECMO and Right Ventricular Failure: Review of the Literature. J Intensive Care Med. 2021;36(3):352-360. doi:10.1177/0885066619900503
5. Burzotta F, Russo G, Basile E, et al. Come orientarsi tra contropulsatore, Impella e ossigenazione a membrana extracorporea. G Ital Cardiol. 2018;19(6):5S-13S. doi:10.1714/2939.29545
6. Agostini C, Stolcova M, Bernardo P, et al. “Tips and Tricks” Sulla Gestione Del Supporto Extracorporeo Alle Funzioni Vitali in Unità Di Terapia Intensiva Cardiologica. G Ital Cardiol. 2018;19(6):14S-22S. doi:10.1714/2939.29546
7. Seese L, Hickey G, Keebler ME, et al. Direct bridging to cardiac transplantation with the surgically implanted Impella 5.0 device. Clin Transplant. 2020;34(3):0-1. doi:10.1111/ctr.13818