La malattia da Coronavirus 2019 (COVID-19) è principalmente caratterizzata da sintomi del tratto respiratorio: nella maggior parte dei casi l’infezione decorre in maniera del tutto asintomatica, in un terzo dei soggetti colpiti possono verificarsi sintomi simil-influenzali, mentre in una minoranza di casi (circa il 5-6%) la malattia può manifestarsi in una forma grave caratterizzata da polmonite interstiziale, insufficienza respiratoria e sindrome da distress respiratorio acuto potenzialmente letale1. Come ben documentato dalla letteratura recente, alcuni fattori di rischio cardiovascolari quali l’ipertensione arteriosa e il diabete mellito aumentano la vulnerabilità al COVID-192. Nei casi di grave infezione da SARs-Cov-2 inoltre sono state riportate alcune complicanze cardiovascolari acute che possono influenzare negativamente la prognosi a breve termine dei pazienti colpiti.
Il caso clinico riportato qui di seguito tratta di un paziente con infezione da COVID-19 ricoverato presso la nostra Divisione durante la prima ondata pandemica per insufficienza cardiaca acuta in una cardiopatia de novo.
CASO CLINICO
Aprile 2020, un uomo di 45 anni, senza precedenti cardiologici e non degni di nota, si reca presso il pronto soccorso del nostro nosocomio per febbre persistente da almeno 3 giorni, dolore toracico e dispnea. Alla valutazione clinica iniziale erano evidenti i segni clinici della congestione polmonare e periferica (grossolani crepitii inspiratori all’auscultazione polmonare ed evidenti edemi declivi bilaterali), i valori pressori erano tendenzialmente bassi (PA 110/80 mmHg) mentre la saturazione di ossigeno in aria ambiente era 93%. Gli esami ematochimici mostravano una grave insufficienza renale (cratininemia 3.1 mg/dl – eGFR 20 ml/min ml/min/1.73m2) e un moderato incremento degli enzimi di miocardiocitolisi (hsTnT 82 ng/L – valore normale < 14 ng/L) e degli indici infiammatori (PCR 30 mg/L – valore normale < 5 mg/L). Il tampone nasofaringeo è risultato positivo per infezione da COVID-19. La TAC del torace mostrava i segni di una polmonite interstiziale bilaterale (reticolazione irregolare inter e intra lobulare con associate aree ‘a vetro smerigliato’ nei territori periferici dei lobi inferiori di entrambi i polmoni; Figura 1).

Figura 1. TAC torace senza mezzo di contrasto. Evidenti le
alterazioni a ‘vetro smerigliato’ che interessano i territori periferici dei lobi inferiori di entrambi i polmoni e sono compatibili con polmonite interstiziale COVID-19 correlata.
Durante l’osservazione in PS è stata richiesta una valutazione cardiologica urgente. Dopo aver preso visione dell’elettrocardiogramma a 12 derivazioni che mostrava una tachicardia sinusale con diffuse alterazioni della ripolarizzazione ventricolare (Figura 2), è stato eseguito un ‘ecocardiogramma fast’ che ha evidenziato una ventricolo sinistro moderatamente dilatato, ipertrofico e con severa disfunzione sistolica globale per diffusa ipocinesia parietale (FE < 30%).

Il paziente è stato quindi ricoverato presso la nostra U.O.C. di Cardiologia ed è stato inizialmente trattato con furosemide in infusione continua ev, supporto ventilatorio non invasivo con CPAP alternato a ossigeno ad alti flussi in maschera Reservoir a 15 L/min, terapia antiretrovirale + copertura antibiotica ed eparina a basso peso molecolare 4000 UI/die. Durante la degenza si è assistito a un lento e progressivo miglioramento delle condizioni cliniche. Nonostante poco tollerata dal paziente per i valori tendenzialmente bassi di PA riscontrati durante la degenza, si è tentata l’introduzione e la gradualmente titolazione della terapia beta-bloccante.
Al nono giorno di degenza è stato ripetuto l’ecocardiogramma che mostrava un iniziale miglioramento della funzione sistolica ventricolare sinistra (FE 38%) e confermava il moderato ispessimento concentrico delle pareti del ventricolo sinistro con aspetto ‘granular sparkling’ più evidente a livello del setto interventricolare (Figura 3a). Le immagini acquisite con la tecnica dello ‘speckle tracking’ longitudinale mostravano una severa riduzione della funzione sistolica longitudinale nelle porzioni medio-basali del ventricolo sinistro con risparmio delle porzioni apicali (Figura 3b-e).
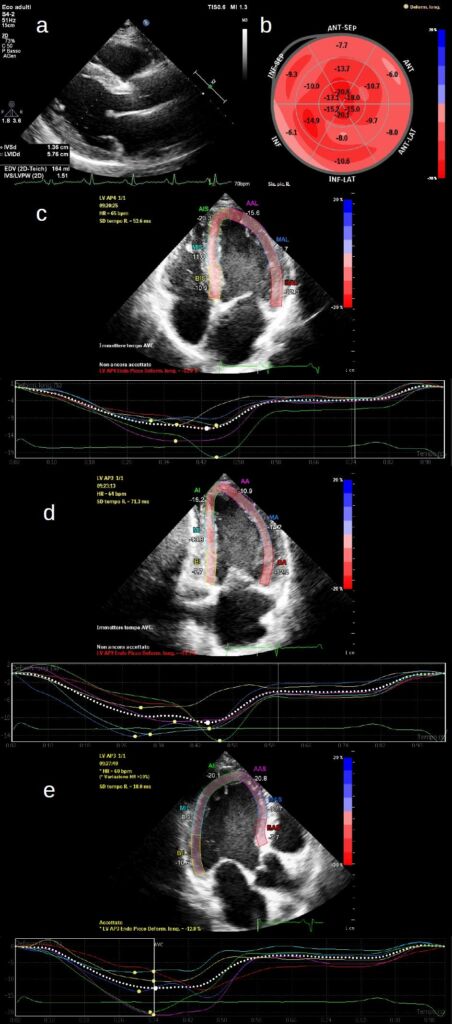
Figura 3. Ecocardiogramma trans- toracico (eseguito al nono giorno di degenza)
a. Proiezione parasternale asse lungo: si noti la moderata ipertrofia parietale del ventricolo sinistro con aspetto ‘granular sparkling’ più evidente a livello del setto interventricolare.
b-e. Valutazione della deformazione longitudinale con la tecnica dello spackle tracking. Evidente la severa riduzione del global longitudinal strain a livello delle porzioni medio-basali del ventricolo sinistro con un relativo risparmio delle porzioni apicali.
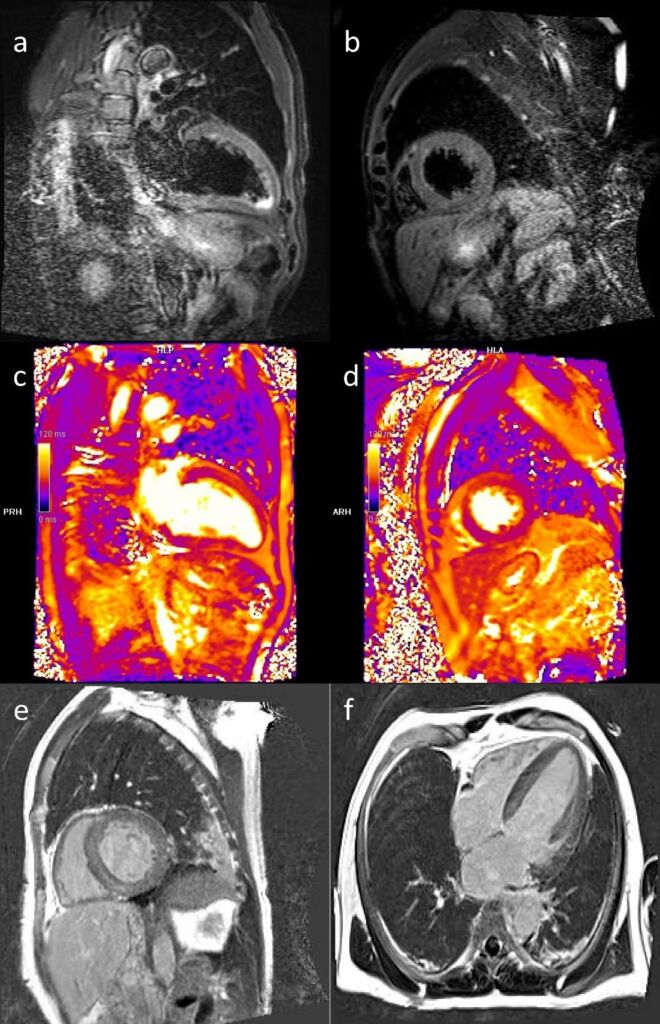
Figura 4. Immagini della RMN cuore (eseguita al 10° giorno di degenza). Le sequenze STIR sia nella proiezione due camere (a) che nella proiezione asse
corto (b) mostrano una lieve iper intensità del segnale miocardico – compatibile con edema miocardico e meglio rappresentato nelle corrispondenti sequenze di mappatura T2 (c; d) – nei segmenti medio-apicale della parete anteriore e del setto anteriore del ventricolo sinistro. Le sequenze acquisite dopo la somministrazione del mezzo di contrasto (e; f) evidenziano un ‘late enhancement’ del gadolinio compatibile con alterazioni della matrice interstiziale diffusa a distribuzione circonferenziale.
Sulla base dei reperti riscontrati e tenendo conto delle risorse utilizzabili in un ospedale periferico come il nostro durante il lockdown per la pandemia in corso, abbiamo deciso di sottoporre il paziente a RMN cuore che ha mostrato la presenza di un edema focale dei segmenti medio-apicale della parete anteriore, compatibile con infiammazione miocardica in fase sub-acuta (Figura 4a-d). Le immagini acquisite dopo la somministrazione di gadolinio hanno invece evidenziato un rapido ‘uptake’ del mezzo di contrasto nel miocardio un ‘late enhancement’ miocardico con distribuzione circonferenziale (Figura 4e-f). In considerazione del forte sospetto clinico-strumentale di una cardiomiopatia infiltrativa e della presenza di alcuni elementi a favore di possibile Amiloidosi di tipo AL sono stati eseguiti elettroforesi proteica urinaria, immunofissazione siero-urine e dosaggio catene leggere libere nel siero e prelievo del grasso periombelicale. Tali accertamenti sono tuttavia risultati tutti negativi. Le condizioni cliniche del paziente dopo quindici giorni di degenza erano decisamente migliorate e pertanto abbiamo deciso di dimettere il paziente e completare l’iter diagnostico programmando un nuovo ricovero a negativizzazione del tampone. La terapia alla dimissione comprendeva bisoprololo 2.5 mg/die, Furosemide 25 mg/die, amlodipina 5 mg/die e gastroprotettore.
Dopo circa 1 mese abbiamo pertanto riaccolto il paziente presso il nostro reparto: lo stesso si presentava in buone condizioni generali. Gli esami ematochimici confermavano la severa insufficienza renale (creatinina 2.9 mg/dL – eGFR 24 ml/min) mentre sia i valori di hs-TnT che gli indici infiammatori erano entro i limiti di normalità. In accordo con il suo curante era stata potenziata la terapia anti-ipertensiva per il non ottimale controllo dei valori pressori. Dopo adeguata preparazione è stato sottoposto a coronarografia di controllo che ha evidenziato la presenza di una moderata coronarosclerosi (stenosi 50% dell’ IVA media; stenosi 50% I° marginale di CX e occlusione di PL di Cdx di piccolo calibro) con indicazione a terapia medica. Grazie alla collaborazione con i colleghi Nefrologi, abbiamo sottoposto il paziente a biopsia renale: i risultati anatomo-patologici hanno mostrato sia segni di danno renale cronico (glomerulo con capsula inspessita e presenza di ialinosi arteriolare) sia segni di danno tubulare acuto diffuso con modesta flogosi interstiziale; non sono invece state riscontrate né particelle virali né depositi di amiloide (Figura 5).

Figura 5. Immagini istologiche derivate dalla biopsia renale. A. Sono evidentii segni di un danno renale cronico: glomerulo con capsula inspessita, normo-cellulato, con anse lievemente collassate e membrane a profilo ondulato; è presente inoltre ialinosi arteriolare e della pre-glomerulare; B. modesta flogosi interstiziale, danno tubulare acuto e minima ‘tubulite’ (reperti compatibili con danno renale acuto).
Alla dimissione sono stati programmati (da eseguire ambulatorialmente) TAC torace e RMN cuore di controllo e Scintigrafia con tracciante osseo. La TAC torace ha evidenziato la pressoché completa risoluzione dell’interstiziopatia polmonare. La RMN cuore eseguita a 2 mesi di distanza ha mostrato la riduzione del volume e l’ulteriore miglioramento della funzione sistolica globale del ventricolo sinistro (FE > 50%); alle immagini T2 pesate era evidente la completa risoluzione dell’edema, mentre le immagini acquisite dopo somministrazione di Gadolinio confermavano la presenza di diffuse alterazioni della matrice interstiziale ma assenza di late enhancement. Infine la scintigrafia con Tecnezio 99-m ha escluso la presenza di depositi di transtiretina a livello miocardico.
DISCUSSIONE
Se inizialmente l’infezione da COVID-19 era stata identificata soprattutto come una patologia respiratoria, con l’aumentare del numero di casi ci si è presto resi conto che una certa quota di pazienti affetti poteva, indipendentemente dalla gravità dell’infezione polmonare, sviluppare una serie di complicanze acute cardiovascolari 2. Un’ entità definita come ‘danno miocardico acuto’ e caratterizzata da un incremento dei livelli plasmatici di troponina, più o meno associati ad alterazioni ECG e/o ecocardiografiche, è ricorremente riportata nei pazienti COVID3. Più raramente si tratta di vere e proprie sindromi coronariche acute, che trovano il loro presupposto fisiopatologico nell’instabilizzazione di placche coronariche pre-esistenti con lo sviluppo di infarto miocardico di tipo 1. Nella maggior parte dei casi tuttavia, queste forme di danno miocardico acuto non sono correlate a una patologia coronarica ma sono la conseguenza dello stato settico e dell’eccesiva attivazione dei sistemi infettivo-infiammatori e possono manifestarsi clinicamente con quadri di miocardite/miocardiopatia da stress3. In letteratura sono descritti alcuni casi simili al nostro in cui la principale manifestazione clinica della malattia da COVID-19 era un quadro di insufficienza cardiaca o shock cardiogeno, causati da infiammazione miocardica documentata con ecocardiogramma e comprovata dalle immagini di RMN cuore4-5-6. Nel lavoro pubblicato da Tavazzi e collaboratori 6 è stata per la prima volta eseguita anche una biopsia endomiocardica che ha documentato la presenza di una modesta infiammazione che riguardava principalmente gli spazi interstiziali con evidenza di cellule linfocitarie e alcuni macrofagi; lo studio al microscopio elettronico ha invece documentato la presenza di particelle virali di diverse dimensioni e di aspetto simile a SARs-Cov-2 all’interno dei macrofagi dello spazio interstiziale. La mancata documentazione, in questa e in altre esperienze, della presenza di particelle virali all’interno dei cardiomiociti ha sollevato alcuni dubbi sia sul fatto che si tratti di vere e proprie miocarditi sia sul fatto che il virus ne sia il diretto responsabile7.
L’insufficienza renale è frequente nei pazienti COVID-19: più del 40% di loro presenta proteinuria al momento del ricovero ospedaliero8 mentre alcuni pazienti critici possono sviluppare durante il ricovero un danno renale acuto9. I fattori patogeni più comuni sembrano correlati al danno renale diretto (promosso dal legame di SARS-CoV-2 ad ACE-2 su cellule tubulari e podociti), alla formazione di microtrombi dovuti all’ipercoagulabilità e agli effetti della risposta infiammatoria sistemica acuta9. I risultati della biopsia renale nel nostro paziente hanno rivelato sia un danno tubulare acuto diffuso con modesta infiammazione interstiziale, sia alterazioni glomerulari e vascolari compatibili con nefropatia ipertensiva cronica. La risoluzione del processo infettivo, tuttavia, non ha portato a un miglioramento significativo della funzione renale, quindi possiamo ipotizzare che in questo paziente l’ipertensione grave non diagnosticata da lungo tempo sia stata la principale causa della sua insufficienza renale.
In conclusione, questo caso clinico ci ha insegnato come una condizione di ipertensione grave e non trattata possa aumentare la vulnerabilità cardiaca all’infezione da COVID-19. Alterazioni infiammatorie acute, anche di entità limitata, possono destabilizzare criticamente un danno d’organo preesistente ad eziologia ipertensiva, portando ad una condizione di grave insufficienza cardiaca e severa disfunzione sistolica ventricolare sinistra. Nonostante le limitazioni legate alla pandemia in corso, per arrivare a una corretta diagnosi è stato fondamentale sia l’utilizzo di un imaging multimodale sia l’approccio meccanicistico alle anomalie cardiache riscontrate.
BIBLIOGRAFIA
1. Sezione sul Coronavirus del portale di epidemiologia italiana Epicentro, su epicentro.iss.it. URL consultato il 1º dicembre 2020
2. Mehra MR, Desai SS, Kuy S, Henry TD, Patel AN. Cardiovascular Disease, Drug Therapy, and Mortality in Covid-19. N Engl J Med. 2020 May 1.
3. Imazio M., Klingel K., Kindermann I., Brucato A., De Rosa F.G., Adler Y. De Ferrari G.M. COVID-19 pandemic and troponin: indirect myocardial injury, myocardial inflammation or myocarditis? Heart 2020;106:1127-1131
4. Sala S, Peretto G, Gramegna M, Palmisano A, Villatore A, Vignale D, De Cobelli F, Tresoldi M, Cappelletti AM, Basso C, Godino C. Acute myocarditis presenting as a reverse Tako-Tsubo syndrome in a patient with SARS-CoV-2 respiratory infection. Eur Heart J 2020
5. Inciardi RM, Lupi L, Zaccone G, Italia L, Raffo M, Tomasoni D, et al. Cardiac Involvement in a Patient With Coronavirus Disease 2019 (COVID-19). JAMA Cardiol. 2020
6. Tavazzi G, Pellegrini C, Maurelli M, Belliato M, Sciutti F, Bottazzi A, Sepe PA, Resasco T, Camporotondo R, Bruno R, Baldanti F, Paolucci S, Pelenghi S, Iotti GA, Mojoli F, Arbustini E. Myocardial localization of coronavirus in COVID-19 cardiogenic shock. Eur J Heart Fail 2020
7. Peretto G., Sala S., Caforio A.L.P. Acute myocardial injury, MINOCA, or myocarditis? Improving characterization of coronarovirus-associated myocardial involvement. European Heart Journal (2020) 0, 1-2
8. Cheng Y, Luo R, Wang K, et al. Kidney disease is associated with in-hospital death of patients with COVID-19. Kidney Int 2020; 97: 829–38
9. Ronco C, Reis T, Husain-Syed F. Management of acute kidney injury in patients with COVID-19. Lancet Respir Med. 2020;S2213-2600(20)30229-0