Una donna di 84 anni, sottoposta nel 2010 a sostituzione valvolare mitralica con impianto di bioprotesi Perimount 29 mm viene riferita al nostro Ambulatorio Cardiopatie Strutturali per dispnea da sforzo ingravescente ed evidenza ecocardiografica di progressivo e significativo aumento dei gradienti transprotesici.
Alla visita la paziente appare in buone condizioni generali, ma in classe NYHA III, con segni di congestione polmonare e periferica.
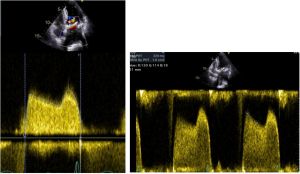
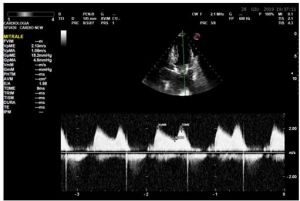
All’ecocardiogramma si rileva un ventricolo sinistro lievemente ipertrofico, non dilatato, con conservata funzione sistolica. Il gradiente medio transprotesico mitralico è 14 mmHg, aumentato rispetto ai controlli seriati portati in visione, che configura una degenerazione in senso stenotico della Perimount, in presenza di camere cardiache destre non dilatate e normocinetiche ma con aumento delle pressioni polmonari (PAPs 53 mmHg)(Figura 1).
Le comorbidità della paziente sono significative: malattia respiratoria cronica ostruttiva di grado moderato, insufficienza renale cronica con filtrato di 25 ml/min, pregressa frattura del bacino che condiziona deambulazione con singolo appoggio, pregressa emorragia cerebrale postraumatica, inoltre i valori calcolati di EUROSCORE e STS score confermano l’elevato rischio operatorio.
La paziente tuttavia conduce e vuole continuare a condurre una vita decisamente attiva e si presenta determinata a correre un certo rischio correlato all’intervento a fronte di un possibile beneficio sintomatologico.
Il caso pertanto viene discusso in Heart Team, la scelta condivisa è di evitare la chirurgia tradizionale e di effettuare un impianto di bioprotesi transcatetere (THV) con metodica valve-in-valve (ViV).
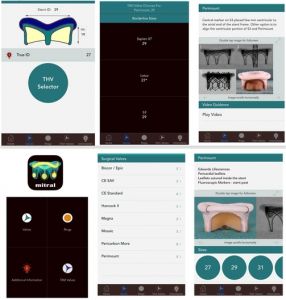
Sulla versione “mitralica” della nota APP valve-in-valve (1) vengono mostrati quali specifici modelli di THV usualmente impiantate in posizione aortica sono utilizzabili “off label” in posizione mitralica in base alla tipologia ed alle misure della bioprotesi degenerata (Figura 2).
Viene pertanto prospettato l’impianto di una Edwards Sapien 3 29 mm e la paziente viene avviata agli accertamenti preoperatori.
IL WORK-UP PREOPERATORIO
In previsione dell’intervento, come consigliato in letteratura (2), vengono effettuati:
- Coronarografia: albero coronarico esente da lesioni
- Ecocardiogramma transesofageo: esclusi eventuali fattori controindicanti l’intervento ovvero trombosi valvolari, vegetazioni a carattere endocarditico, leak paravalvolari severi, deiscenze della bioprotesi
- TC torace con mdc: confermati i dati acquisiti con ecocardiogramma transesofageo ed effettuate precise misurazioni dei diametri della valvola degenerata per ulteriore conferma della compatibilità della THV selezionata per l’impianto (3). Con la TC e le ricostruzioni successive viene anche scongiurato il rischio periprocedurale di causare ostruzione dinamica al tratto di efflusso ventricolare sinistro (LVOT). Si tratta della complicanza più frequente delle procedure ViV mitraliche e risulta inversamente proporzionale alla misura dell’LVOT e della cavità ventricolare, ma è anche correlato alla presenza di angolo mitro-aortico acuto o alla presenza di lembi anteriori o apparati sottovalvolari estremamente ridondanti. Relativamente a questa problematica, le bioprotesi degenerate sono a minore rischio rispetto alle failure di anelli valvolari e plastiche valvolari, essendo in queste ultime stato asportato al momento del primo intervento tutto l’eventuale tessuto ridondate nativo (4-6)
Visti gli esami effettuati non si sono evidenziate controindicazioni all’intervento che pertanto viene schedulata ed illustrata alla paziente.
LA PROCEDURA E IL DECORSO POSTOPERATORIO
In questo tipo di procedura, l’approccio transapicale ha il vantaggio di offrire maggior rapidità ed un più immediato allineamento coassiale rispetto alla bioprotesi degenerata ma paga il prezzo di una maggiore invasività che la fragilità della nostra paziente non ci permette (Figura 3).
Pertanto, previa anestesia generale e monitoraggio ecocardiografico transesofageo, viene scelto un approccio percutaneo transfemorale (vena femorale destra, preparata alla chiusura con pre-impianto di Proglide).

Il successivo accesso alle camere cardiache sinistre avviene attraverso puntura trans-settale effettuata in sede superiore e posteriore, (come avviene nelle procedure di Mitraclip), per ottenere una migliore navigabilità all’interno dell’atrio sinistro
Una volta guadagnato l’accesso all’atrio sinistro, si procede all’ eparinizzazione sistemica e, attraverso un catetere steerable, con una guida idrofilica 0,035” si attraversa la bioprotesi degenerata.
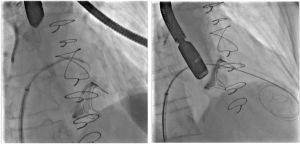
Una volta posizionata stabilmente la guida in ventricolo sinistro, si procede allo scambio con device ad elevato supporto (Safari small curve come guida operativa, ed Amplatz Superstiff come buddywire) (Figura 4).
Non si procede a predilatare la bioprotesi degenerata per scongiurare il rischio di embolizzazione di frammenti di calcio o di esitare in insufficienza valvolare massiva ed acuta. La predilatazione è genericamente da considerare nel caso di difficoltà al posizionamento della THV attraverso la bioprotesi degenerata, ma il pallone utilizzato deve essere sottodimensionato rispetto al diametro reale e va considerata la possibilità di utilizzo di filtri di protezione cerebrale.
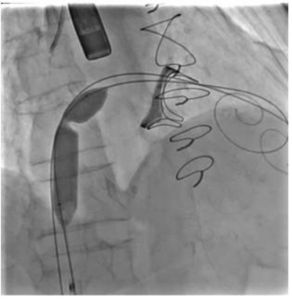
Successivamente si procede alla dilatazione del setto interatriale per permettere il passaggio del delivery Edwards. Si effettuano multipli gonfiaggi con pallone da 14 mm al fine di creare una “strada” del diametro adeguato ad evitare eventuali intrappolamenti dei dispositivi (Figura 5).
La Sapien 3 29 mm viene montata sul delivery ruotata di 180 gradi rispetto al suo consueto orientamento nella procedura di TAVR e viene posizionata all’interno della bioprotesi degenerata, con difficoltà all’avanzamento causate dello scarso supporto offerto dalla parete vascolare venosa e dalla tortuosità del decorso del sistema.
La valvola viene poi rilasciata, in assenza di rapid pacing, con un rapporto 80% ventricolare e 20% atriale. Il principale rischio di questo passaggio è l’embolizzazione del device (Figura 6).

La valvola, una volta impiantata, presenta un gradiente medio di circa 4 mmHg, non si evidenziano leak significativi, pertanto si procedere al ritiro del sistema e all’emostasi.
Il successivo decorso della paziente vede circa quattro giorni di ventilazione meccanica, diverse emotrasfusioni, necessità di terapia antibiotica, un transitorio danno renale acuta da mezzo di contrasto, un episodio di fibrillazione atriale cardiovertito farmacologicamente ma è progressivamente migliorato.
A due settimane dell’intervento la paziente viene dimessa con parametri ecocardiografici sovrapponibili al dato postimpianto (Figura 7).
LA TERAPIA ANTITROMBOTICA
Per quanto riguarda la terapia antitrombotica in questo specifico ambito clinico è noto che non c’è uno standard di riferimento.
La più grande quantità di dati riguardanti ViV e valve-in-ring (ViR) mitralica derivano da studi osservazionali che utilizzano THV originariamente progettate per la sostituzione della valvola aortica, principalmente le valvole balloon expandable Sapien (7, 8-28).La crescente esperienza con questi interventi e le prime segnalazioni di trombosi hanno portato a una maggiore consapevolezza riguardo al rischio di complicanze trombotiche dopo ViV e ViR mitralica (29-32).Sebbene il grande registro multicentrico VIVID (Valve-in Valve International Data) non abbia ancora riportato dati sul trattamento antitrombotico e sulla trombosi da THV dopo ViV mitralica e ViR (28), approfondimenti rilevanti provengono da un registro multicentrico specifico recentemente pubblicato (7). Questo studio ha incluso 322 pazienti ViV e 141 ViR trattati con diversi THV, riportando informazioni sulla terapia antitrombotica alla dimissione e sulla trombosi-THV in 411 su 521 pazienti. In questo sottogruppo, il 71,8% dei pazienti ha ricevuto terapia anticoagulante e il restante 28,2% ha ricevuto terapia antipiastrinica. La trombosi da THV si è verificata in 10 casi (9 ViV e 1 ViR), con una tempistica che varia in modo significativo dai primi giorni a 2 anni dopo la procedura. È interessante notare che il tasso cumulativo ad un anno di trombosi da THV era significativamente più alto nei pazienti senza anticoagulanti rispetto a quelli con anticoagulanti (6,6% contro 1,6%; p 0,019), supportando il ruolo protettivo di una strategia basata su anticoagulanti sul rischio di complicanze trombotiche dopo ViV/ViR (7) (Figura 8).

Inoltre, un recente studio prospettico monocentrico ha riportato un tasso cumulativo a 2 anni di trombosi da THV del 14,4% tra 91 pazienti trattati con ViV, ViR o ViMAC; tutti i pazienti erano asintomatici e la trombosi si è risolta in tutti i casi con anticoagulanti orali (AVK) (10).
Sebbene spesso considerati insieme, ViV mitralica e ViR sono procedure diverse con caratteristiche tecniche e anatomiche specifiche che potrebbero teoricamente contribuire al rischio trombotico. Ad esempio, nelle procedure ViR, la posizione relativa della THV rispetto all’anello potrebbe determinare uno spazio perivalvolare a basso flusso sul lato atriale della bioprotesi o all’interfaccia tra THV e apparato valvolare nativo, potenzialmente modificando i flussi ed aumentando la trombogenicità locale. D’altra parte, la ViV determina una diversa interazione geometrica tra valvole protesiche e strutture native, dove la presenza e il tipo specifico di bioprotesi chirurgica degenerata potrebbe giocare un ruolo nel rischio trombotico locale. Nel registro TMVR (7), sebbene i pazienti ViR presentassero una frazione di eiezione ventricolare inferiore sinistra rispetto a ViV (che rappresenta una condizione di flusso inferiore), la stragrande maggioranza degli eventi di trombosi da THV si è verificata dopo ViV (90,9%); inoltre, la trombosi dopo ViV mitralica è stata osservata più frequentemente nelle valvole suine degenerate (n=9) rispetto alle valvole pericardiche degenerate (n=1), coerentemente con i dati precedenti sulla sostituzione chirurgica della valvola aortica e sulla ViV aortica transcatetere (33-35).
La trombosi delle bioprotesi è un fenomeno multifattoriale derivante dall’interazione tra fattori correlati alla valvola ed al paziente. I primi dati suggeriscono un rischio non trascurabile di trombosi clinicamente conclamata a breve e medio termine, potenzialmente più alto di quello osservato dopo TAVR. Il tasso più basso di trombosi da THV osservato da Yoon et al. (7) tra i pazienti trattati con terapia anticoagulante, così come l’evidenza indiretta ottenuta dalle prime esperienze con nuovi dispositivi per sostiuzione mitralica transcatetere (TMVR) (Tendyne, Intrepid), suggeriscono che la tromboprofilassi anticoagulante può essere utile dopo le procedure TMVR, in linea con l’attuale pratica clinica dopo la sostituzione valvolare mitralica con impianto di bioprotesi. Quindi, sembra ragionevole prescrivere VKA nei primi mesi dopo qualsiasi procedura TVMR in pazienti che non hanno un’indicazione per l’anticoagulazione a lungo termine. La durata della terapia anticoagulante e l’eventuale associazione della terapia antipiastrinica deve essere basata sulle caratteristiche ed al rischio emorragico del singolo paziente (Figura 9).
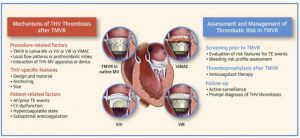
Inoltre, poiché le caratteristiche specifiche del dispositivo potrebbero avere un impatto sulla trombogenicità, l’intensità del regime antitrombotico andrebbe adattata al tipo di THV impiantato; tuttavia, al momento non è possibile fornire raccomandazioni specifiche per l’assenza di studi dedicati.
Il follow-up clinico e di imaging seriale (sia prima che dopo l’interruzione della terapia anticoagulante), con un attento bilancio dei profili di rischio tromboembolico ed emorragico individuali, può guidare dinamicamente l’intensità e la durata della terapia antitrombotica dopo TMVR.
Inoltre, in assenza di studi randomizzati dedicati nel campo TMVR, è possibile trarre insegnamento dal GALILEO. Questo studio ha valutato una strategia basata su anticoagulanti orali diretti dopo TAVR in soggetti senza un’indicazione stabilita per anticoagulanti orali a lungo termine, randomizzando i pazienti a rivaroxaban 10 mg una volta al giorno più aspirina da 75 a 100 mg per 3 mesi seguiti da rivaroxaban da solo rispetto a doppia terapia antipiastrinica (clopidogrel 75 mg più aspirina da 75 a 100 mg) per 3 mesi seguita da sola aspirina (36). Lo studio GALILEO è stato interrotto anticipatamente a causa di un aumento del rischio di mortalità, eventi tromboembolici e sanguinamento nei pazienti randomizzati al braccio rivaroxaban; questi risultati preliminari potrebbero portare a diverse speculazioni contrastanti, da un lato sollevando sospetti di un effetto tromboprofilattico subottimale di rivaroxaban a basso dosaggio, ma dall’altro suggerendo un aumento del rischio di sanguinamento con una strategia anticoagulante più antipiastrinica in pazienti anziani sottoposti a TAVR. A differenza della TAVR, l’anticoagulazione orale con AVK sembra essere necessaria per la tromboprofilassi dopo TMVR e, allo stesso tempo, le preoccupazioni sul rischio di sanguinamento sono particolarmente rilevanti nei pazienti ad alto rischio o inoperabili attualmente indirizzati per TMVR. Pertanto, evitare la terapia antitrombotica combinata o la terapia anticoagulante prolungata nei pazienti ad alto rischio di sanguinamento potrebbe essere utile, riservando una terapia anticoagulante intensa (obiettivo INR alto e durata prolungata) o una terapia anticoagulante e antiaggregante piastrinica combinata nei pazienti a basso rischio di sanguinamento o con caratteristiche di rischio trombotico particolarmente elevato (es. pazienti con precedente evento tromboembolico o dopo ViV mitralica in valvole suine con stent degenerate). Da segnalare l’evidenza disponibile sulla tromboprofilassi dopo TMVR si basa quasi esclusivamente sull’anticoagulazione orale con AVK, con un numero estremamente basso di pazienti trattati con anticoagulanti orali diretti nei primi studi disponibili Nei pazienti ritenuti a rischio emorragico molto elevato (proibitivo), con un rischio atteso di eventi emorragici correlati agli anticoagulanti potenzialmente più alto e più preoccupante del rischio tromboembolico correlato alla THV, l’adozione di una strategia solo antipiastrinica senza anticoagulante sembra essere inevitabile; in questi casi, si consiglia un rigoroso follow-up clinico e di imaging per escludere il verificarsi di trombosi. Da notare, in una proporzione rilevante di pazienti attualmente trattati con TMVR, la terapia antitrombotica è principalmente guidata dalle comorbidità sottostanti, in particolare la fibrillazione atriale (che potenzialmente determina un’indicazione indipendente per l’anticoagulazione). Inoltre, poiché la chiusura concomitante dell’appendice atriale sinistra (LAAC) durante la sostituzione chirurgica mitralica ha dimostrato di ridurre l’incidenza di eventi tromboembolici al follow-up (37), la LAAC percutanea potrebbe teoricamente essere utile in un sottogruppo di pazienti attualmente sottoposti a TMVR; tuttavia, ad oggi non sono disponibili studi dedicati sul ruolo additivo del LAAC in questa specifica popolazione.
Dopo discussione collegiale, per la nostra paziente scegliamo un approccio personalizzato e discretamente al di fuori del rigore delle evidenze attuali sopraelencate: anticogualante diretto (Edoxaban 30 mg/die, vista la funzione renale) associato a un singolo antiaggregante (ASA).
Alla visita di controllo ad un mese dall’intervento la paziente è clinicamente migliorata e si presente decisamente soddisfatta.
Gli esami ematochimici risultato stabili l’ecocardiogramma è invariato rispetto alla dimissione. All’ECG è presente aritmia da fibrillazione atriale, normofrequente che condiziona la nostra terapia antitrombotica a lungo termine: confermiamo infatti edoxaban associato ad aspirina.
Visto il risultato, decidiamo di non sottoporre la paziente ad ulteriori indagini (ecocardiogramma transesofageo o TC con mezzo di contrasto) volte a svelare eventuale trombosi valvolare subclinica, ritenendole sicuramente interessanti dal punto di vista scientifico ma non indicate dal punto di vista clinico, sulla base della situazione del momento.
BIBLIOGRAFIA
- Bapat V. Valve-in-valve apps: why and how they were developed and how to use them. EuroIntervention 2014;10 Suppl U:U44–51.
- Urena M., Himbert D., Brochet E., et al. Transseptal Transcatheter Mitral Valve Replacement Using Balloon-Expandable Transcatheter Heart Valves: A Step-by-Step Approach,JACC: Cardiovascular Interventions,Volume 10, Issue 19,2017, 1905-1919,
- Bapat VN, Attia R, Thomas M. Effect of valve design on the stent internal diameter of a bio- prosthetic valve: a concept of true internal diameter and its implications for the valve-in-valve procedure. J Am Coll Cardiol Intv 2014;7:115–27.
- Bapat V, Pirone F, Kapetanakis S, Rajani R, Niederer S. Factors influencing left ventricular outflow tract obstruction following a mitral valve- in-valve or valve-in-ring procedure, part 1. Catheter Cardiovasc Interv 2015;86:747–60.
- Blanke P, Naoum C, Dvir D, et al. Predicting LVOT obstruction in transcatheter mitral valve implantation: concept of the neo-LVOT. J Am Coll Cardiol Img 2017;10:482–5.
- Wang DD, Eng M, Greenbaum A, et al. Predicting LVOT obstruction after TMVR. J Am Coll Cardiol Img 2016;9:1349–52.
- Yoon S-H, Whisenant BK, Bleiziffer S, et al. Outcomes of transcatheter mitral valve replace- ment for degenerated bioprostheses, failed annuloplasty rings, and mitral annular calcification. Eur Heart J 2019;40:441–51.
- Kornowski R, Dvir D. Transcatheter mitral valve-in-valve and valve-in-ring (VIVID Registry). Paper presented at: The Structural Heart Disease Summit; June 21, 2018; Chicago, Illinois.
- Eleid MF, Whisenant BK, Cabalka AK, et al. Early outcomes of percutaneous transvenous transseptal transcatheter valve implantation in failed bioprosthetic mitral valves, ring annuloplasty, and severe mitral annular calcification. J Am Coll Cardiol Intv 2017;10:1932–42.
- Urena M, Brochet E, Lecomte M, et al. Clinical and haemodynamic outcomes of balloon- expandable transcatheter mitral valve implantation: a 7-year experience. Eur Heart J 2018;39: 2679–89.
- Kamioka N, Babaliaros V, Morse MA, et al. Comparison of clinical and echocardiographic outcomes after surgical redo mitral valve replacement and transcatheter mitral valve-in- valve therapy. J Am Coll Cardiol Intv 2018;11: 1131–8.
- Guerrero M. MITRAL (Mitral Implantation of TRAnscatheter vaLves) – 30-day outcomes of transcatheter MV replacement in patients with severe mitral valve disease secondary to mitral annular calcification or failed annuloplasty rings. Paper presented at: Transcatheter Cardiovascular Therapeutics (TCT); November 1, 2017; Denver, Colorado.
- Ye J, Cheung A, Yamashita M, et al. Trans- catheter aortic and mitral valve-in-valve implantation for failed surgical bioprosthetic valves: an 8-year single-center experience. J Am Coll Car- diol Intv 2015;8:1735–44.
- Frerker C, Schmidt T, Schlüter M, et al. Transcatheter implantation of aortic valve prostheses into degenerated mitral valve bio- prostheses and failed annuloplasty rings: out- comes according to access route and Mitral Valve Academic Research Consortium (MVARC) criteria. EuroIntervention 2016;12:1520–6.
- Himbert D. Transcatheter valve replacement for ring annuloplasty failures: valve-in-ring results. Paper presented at: Transcatheter Cardio- vascular Therapeutics (TCT); October 30, 2016; Washington, DC.
- Cheung A, Webb JG, Barbanti M, et al. 5-year experience with transcatheter transapical mitral valve-in-valve implantation for bioprosthetic valve dysfunction. J Am Coll Cardiol 2013;61: 1759–66.
- Bouleti C, Fassa A-A, Himbert D, et al. Trans- femoral implantation of transcatheter heart valves after deterioration of mitral bioprosthesis or pre- vious ring annuloplasty. J Am Coll Cardiol Intv 2015;8:83–91.
- Descoutures F, Himbert D, Maisano F, et al. Transcatheter valve-in-ring implantation after failure of surgical mitral repair. Eur J Cardiothoracic Surg 2013;44:e8–15.
- Eng MH, Greenbaum A, Wang DD, et al. Thrombotic valvular dysfunction with trans- catheter mitral interventions for postsurgical failures. Catheter Cardiovasc Interv 2017;90:321–8.
- Wilbring M, Alexiou K, Tugtekin SM, et al. Pushing the limits-further evolutions of trans- catheter valve procedures in the mitral position, including valve-in-valve, valve-in-ring, and valve- in-native-ring. J Thorac Cardiovasc Surg 2014;147: 210–9.
- Schäfer U, Bader R, Frerker C, et al. Balloon- expandable valves for degenerated mitral xenografts or failing surgical rings. EuroIntervention 2014;10:260–8.
- Whisenant B, Jones K, Miller D, Horton S, Miner E. Thrombosis following mitral and tricuspid valve-in-valve replacement. J Thorac Cardiovasc Surg 2015;149:e26–9.
- Cullen MW, Cabalka AK, Alli OO, et al. Trans- venous, antegrade Melody valve-in-valve implantation for bioprosthetic mitral and tricuspid valve dysfunction: a case series in children and adults. J Am Coll Cardiol Intv 2013;6:598–605.
- Latib A, Ruparelia N, Bijuklic K, et al. First-in- man transcatheter mitral valve-in-ring implantation with a repositionable and retrievable aortic valve prosthesis. EuroIntervention 2016;11: 1148–52.
- Seiffert M, Conradi L, Baldus S, et al. Trans- catheter mitral valve-in-valve implantation in patients with degenerated bioprostheses. J Am Coll Cardiol Intv 2012;5:341–9.
- Kliger C, Angulo R, Maranan L, et al. Percutaneous complete repair of failed mitral valve prosthesis: simultaneous closure of mitral paravalvular leaks and transcatheter mitral valve implantation – single-centre experience. Euro- Intervention 2015;10:1336–45.
- Cerillo AG, Chiaramonti F, Murzi M, et al. Transcatheter valve in valve implantation for failed mitral and tricuspid bioprosthesis. Catheter Cardiovasc Interv 2011;78:987–95.
- Cheung A, Denti P, Kiaii B, et al. Mitral valve-in- ring implantation with a dedicated transcatheter mitral valve replacement system. J Am Coll Cardiol Intv 2017;10:2012–4.
- Beneduce A, Capogrosso C, Stella S, et al. Subclinical leaflet thrombosis after transcatheter mitral valve-in-ring implantation. J Am Coll Cardiol Intv 2018;11:e105–6. severe mitral annular calcification. J Thorac Car- diovasc Surg 2018;156:132–42.
- Roosen J, Haemers P, Ameloot K, De Praetere H. Low-dose and slow- infusion thrombolysis for prosthetic valve thrombosis after a transcatheter valve in the mitral position. J Am Coll Cardiol Intv 2017;10:738–9.
- Quick S, Speiser U, Strasser RH, Ibrahim K. First bioprosthesis thrombosis after transcatheter mitral valve-in-valve implantation: diagnosis and treatment. J Am Coll Cardiol 2014;63:e49.
- Capretti G, Urena M, Himbert D, et al. Valve thrombosis after transcatheter mitral valve replacement. J Am Coll Cardiol 2016;68:1814–5.
- Brown ML, Park SJ, Sundt TM, Schaff HV. Early thrombosis risk in patients with biologic valves in the aortic position. J Thorac Cardiovasc Surg 2012;144:108–11.
- Jander N, Sommer H, Pingpoh C, et al. The porcine valve type predicts obstructive thrombosis beyond the first three postoperative months in bioprostheses in the aortic position. Int J Cardiol 2015;199:90–5.
- Jose J, Sulimov DS, El-Mawardy M, et al. Clinical bioprosthetic heart valve thrombosis after transcatheter aortic valve replacement: incidence, characteristics, and treatment outcomes. J Am Coll Cardiol Intv 2017;10:686–97.
- Windecker S, Tijssen J, Giustino G, et al. Trial design: rivaroxaban for the prevention of major cardiovascular events after transcatheter aortic valve replacement: rationale and design of the GALILEO study. Am Heart J 2017;184: 81–7.
- García-Fernández MA, Pérez-David E, Quiles J, et al. Role of left atrial appendage obliteration in stroke reduction in patients with mitral valve prosthesis: a transesophageal echocardiographic study. J Am Coll Cardiol 2003;42: 1253–8.