A marzo 2019, un uomo di 27 anni inizia a lamentare febbricola, vomito e inappetenza, seguite dopo alcuni giorni da dolore toracico oppressivo, persistente e modificato dalla postura e dal respiro.
In anamnesi non vi sono antecedenti cardiologici di rilievo. L’uomo è affetto da ipotiroidismo autoimmune in terapia sostitutiva e diabete mellito di tipo I, per il quale era stata recentemente interrotta l’assunzione di insulina grazie al buon compenso glicemico mantenuto con la sola dieta.
Nei giorni successivi il paziente allerta il 118 con trasporto in Pronto Soccorso per insorgenza di dispnea rapidamente ingravescente, turgore giugulare e infine marezzatura degli arti inferiori. Un ecocardiogramma trans-toracico in urgenza mostra un versamento pericardico severo con segni di franco tamponamento cardiaco.
Il paziente viene trasferito in urgenza in sala di emodinamica dove viene sottoposto a pericardiocentesi evacuativa, con drenaggio di 1200 cc di liquido siero-ematico (Figura 1).
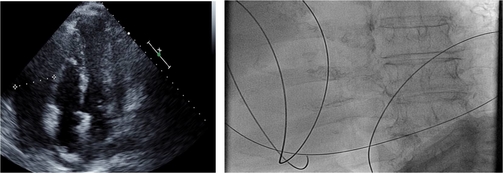
Dopo la procedura si assiste alla rapida comparsa di un quadro di shock, con minima risposta a supporto fluido e aminico massimali. Nel sospetto di perdita ematica attiva, si procede al trasferimento in Sala Operatoria Cardiochirurgica per esecuzione di sternotomia mediana, con ulteriore drenaggio di 300 cc di liquido sieroso ed esclusione di fonti di sanguinamento evidenti. Durante la procedura vengono prelevati campioni di pericardio, miocardio e liquido pericardico per analisi anatomo-patologica.
All’ecocardiogramma post-procedurale viene documentata una severa disfunzione biventricolare, con prevalente coinvolgimento delle sezioni destre. Viene dunque posizionato un contropulsatore aortico ed eseguita coronarografia, che mostra coronarie indenni da lesioni angiograficamente significative.
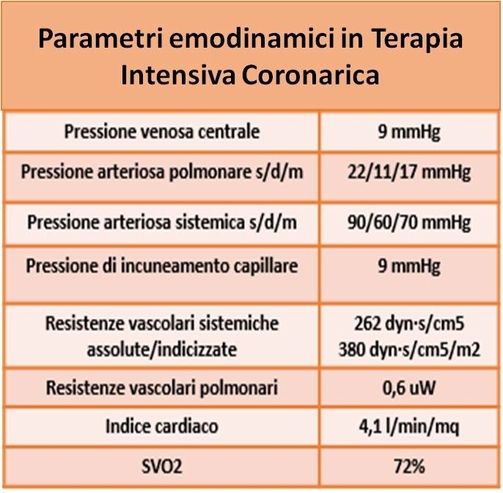
Il paziente viene trasferito in Terapia Intensiva Coronarica, dove persiste uno stato di shock minimamente responsivo alle misure di supporto. Al monitoraggio dei parametri emodinamici tramite catetere di Swan-Gantz (Tabella 1), si configura un quadro di shock distributivo, che viene trattato come shock settico.
Il paziente presenta infatti dei valori normali di indice cardiaco, pressioni e resistenze polmonari, con basse resistenze sistemiche.
Per il sospetto di una contemporanea componente miocarditica che potesse giustificare il quadro ecocardiografico, viene iniziata terapia cortisonica.
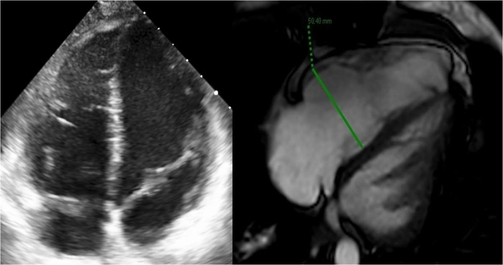
Nei giorni successivi il quadro si stabilizza progressivamente, con svezzamento dal supporto emodinamico. Viene pertanto eseguita una risonanza magnetica cardiaca che mostra un miglioramento rispetto al quadro ecocardiografico, documentando l’assenza di alterazioni tissutali del miocardio. Infatti lo di perfusione di primo passaggio, del late gadolinium enhancement, del T1 e del T2 mapping risultano tutti nella norma (Figura 2).
Nel frattempo pervengono i risultati anatomo-patologici che mostrano un quadro di pericardite acuta con infiltrato granulocitario in assenza di interessamento del muscolo cardiaco.
Il paziente viene trasferito in reparto di degenza per la prosecuzione dell’iter. A questo punto, con un nuovo raccordo anamnestico e i dati a nostra disposizione, veniva effettuato un tentativo di diagnosi:
- Dal punto di vista cardiocircolatorio abbiamo un quadro di pericardite acuta e disfunzione biventricolare, senza apparenti alterazioni del muscolo cardiaco né agli esami di imaging né all’anatomia patologica. Inoltre, nonostante l’evidenza di disfunzione sistolica, i parametri emodinamici in Terapia Intensiva Cardiologica configuravano un quadro di shock distributivo piuttosto che cardiogeno, migliorato soprattutto dopo somministrazione di cortisone.
- Come comorbidità il paziente presenta ipotiroidismo autoimmune e diabete mellito di tipo 1.
- All’esame obiettivo viene riscontrata iperpigmentazione cutanea mentre agli esami ematici sono evidenti ipokaliemia e iponatremia. Il paziente riferisce negli ultimi anni profusa astenia, calo ponderale ed episodi di dolore addominale crampiforme. Viene perciò eseguito il dosaggio di renina, aldosterone, ACTH e cortisolo plasmatico con dei risultati compatibili con insufficienza surrenalica cronica (malattia di Addison).

A questo punto vi sono i criteri per la diagnosi di sindrome polighiandolare autoimmune di tipo 2 o sindrome di Schmidt, consentendoci di identificare lo shock distributivo del paziente come una crisi addisoniana indotta verosimilmente dal tamponamento cardiaco.
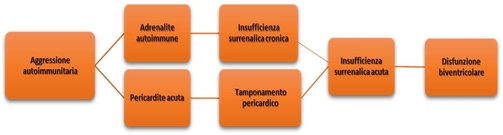
In letteratura vi sono numerosi articoli che identificano un’associazione tra le endocrinopatie autoimmuni e quadri di sierosite, inclusa la pericardite. In particolare, in uno studio retrospettivo del 19872 riguardante una serie di 20 pazienti affetti da endocrinopatia seguiti in un lasso di tempo di 15 anni, vengono riportati 45 episodi di sierosite, di cui 13 di pericardite. Di questi 20 pazienti, 7 risultavano affetti da sindrome di Schmidt. Nello stesso articolo viene ipotizzata una correlazione con gli immunocomplessi circolanti che vengono riscontrati frequentemente nel sangue ematico di questi pazienti. Tali immunocomplessi causerebbero un’aggresione autoimmunitaria delle sierose tramite un meccanismo di ipersensibilità di tipo III (Figura 3).
Se però l’aggressione autoimmunitaria giustifica il quadro di pericardite, questa non spiega invece la severa disfunzione biventricolare del nostro paziente. Tuttavia nella letteratura vi sono casi simili al nostro, dove una severa disfunzione cardiaca, frequentemente reversibile e senza alterazioni strutturali del miocardio, si verificava in pazienti con insufficienza surrenalica cronica, spesso esordita con crisi addisoniana2,3,4. Uno di questi casi riguardava un paziente con sindrome di Schmidt5 mentre un altro mostrava una disfunzione prevalente delle sezioni destre del cuore6, come nel nostro caso.
La causa di questa disfunzione è ignota. A nostra disposizione vi sono alcuni studi su modello animale che avrebbero mostrato una diminuità capacità da parte del muscolo cardiaco di impiegare le proprie riserve energetiche per un alterazione del metabolismo del calcio e della fosforilazione microsomiale, che si verificherebbero in condizioni di carenza di ormoni surrenali. Un’altra possibile spiegazione è una vulnerabilità aumentata del muscolo cardiaco nei confronti di uno stress adrenergico, a causa della deplezione di corticosteroidi che agirebbero come protettori nei confronti delle catecolammine. Non si creerebbe tuttavia un danno strutturale del miocita, spiegando così il completo ripristino della funzione cardiaca dopo somministrazione di terapia ormonale sostitutiva 7,8,9,10.
Volendo ipotizzare una possibile sequenza degli eventi che spieghi l’intero quadro del nostro paziente, è stata elaborata la figura sottostante:
La disfunzione biventricolare del nostro paziente rientra a pieno diritto nella definzione di cardiomiopatia dilatativa, data da Eliot et al. nel 200811. Il paziente non presentava infatti ipertensione, valvulopatie, coronaropatie o aritmie che potessero giustificare altrimenti la disfunzione cardiaca, e nell’elenco delle cause di cardiomiopatia dilatativa vengono riportate anche le endocrinopatie.
Il paziente viene dimesso in terapia ormonale sostitutiva con idrocortisone e fludrocortisone, e con ibuprofene e colchicina, seguendo le linee guida ESC per il trattamento delle malattie del pericardio12.
Attualmente si presenta in buone condizioni generali e di compenso cardiocircolatorio. Si è assistito a un aumento del peso corporeo e dei livelli di energia, con completa risoluzione dell’iperpigmentazione e della disfunzione biventricolare all’ecocardiografia di follow-up. Sfortunatamente, nel corso di vari tentativi di decalage della terapia con colchicina, si è verificata una rapida recidiva della pericardite, per cui il paziente sta ancora assumendo tale farmaco in attesa di valutare l’inizio di eventuali terapie di secondo livello.
1: Tucker WS Jr, Niblack GD, et al. Serositis with autoimmune endocrinopathy: clinical and immunogenetic features. Medicine (Baltimore). 1987 Mar;66(2):138-47. doi: 10.1097/00005792-198703000-00005. PMID: 3493414.
2: Mozolevska V, Schwartz A, et al. Addison’s Disease and Dilated Cardiomyopathy: A Case Report and Review of the Literature. Case Rep Cardiol. 2016;2016:4362514. doi: 10.1155/2016/4362514. Epub 2016 Nov 28. PMID: 28003914; PMCID: PMC5149592.
3: Dimarakis I, Shaw S, et al. Durable left ventricular assist device as a bridge to recovery for addisonian crisis related cardiomyopathy. J Card Surg. 2017 Oct;32(10):665-666. doi: 10.1111/jocs.13209. Epub 2017 Sep 11. PMID: 28895194.
4: Kristen A. Hyland, Daniel S. Altman, et al. Reversible Heart Failure as a Result of Newly Diagnosed Primary Adrenal Insufficiency, AACE Clinical Case Reports, Volume 2, Issue 4, 2016, Pages e321-e324, ISSN 2376-0605, https://doi.org/10.4158/EP15835.CR.
5: Karavelioglu Y, Baran A, et al. Reversible cardiomyopathy associated with autoimmune polyendocrine syndrome type II. Intern Med. 2013;52(9):981-5. doi: 10.2169/internalmedicine.52.7188. Epub 2012 Mar 1. PMID: 23648718.
6: Shimizu M, Monguchi T, et al. Isolated ACTH deficiency presenting with severe myocardial dysfunction. J Cardiol Cases. 2011 Jun 15;4(1):e26-e30. doi: 10.1016/j.jccase.2011.05.004. PMID: 30546710; PMCID: PMC6265152.
7: Narayanan N. Effects of adrenalectomy and in vivo administration of dexamethasone on ATP-dependent calcium accumulation by sarcoplasmic reticulum from rat heart. J Mol Cell Cardiol 15: 7-15, 1983.
8: Narayanan N, Khandelwal RL. Microsomal phosphorylase in rat heart: depletion following adrenalectomy and restoration by in vivo administration of dexamethasone. Endocrinology. 1985 Oct;117(4):1544-9. doi: 10.1210/endo-117-4-1544. PMID: 2992913.
9: Rovetto MJ, Murphy RA, Lefer AM. Cardiac impairment in adrenal insufficiency in the cat. Reduced adenosinetriphosphatase activity of myocardial contractile proteins. Circ Res. 1970 Apr;26(4):419-28. doi: 10.1161/01.res.26.4.419. PMID: 4244919.
10: Cleghorn RA. Cardiovascular failure in experimental adrenal insufficiency: a historical revival. Perspect Biol Med. 1983 Autumn;27(1):135-55. doi: 10.1353/pbm.1983.0003. PMID: 6359051.
11: Elliott P, Andersson B, et al. Classification of the cardiomyopathies: a position statement from the European Society Of Cardiology Working Group on Myocardial and Pericardial Diseases. Eur Heart J. 2008 Jan;29(2):270-6. doi: 10.1093/eurheartj/ehm342. Epub 2007 Oct 4. PMID: 17916581.
12: Yehuda Adler, Philippe Charron, et al. ESC Scientific Document Group, 2015 ESC Guidelines for the diagnosis and management of pericardial diseases: The Task Force for the Diagnosis and Management of Pericardial Diseases of the European Society of Cardiology (ESC). Endorsed by: The European Association for Cardio-Thoracic Surgery (EACTS), European Heart Journal, Volume 36, Issue 42, 7 November 2015,Pages 2921–2964, https://doi.org/10.1093/eurheartj/ehv318