Un uomo di 37 anni di origine pakistana privo di antecedenti cardiologici noti, viene ricoverato per sepsi di origine sconosciuta. In anamnesi risultano un ipotiroidismo post-chirurgico per gozzo multinodulare tossico, un’insufficienza renale cronica terminale ad eziologia ignota in terapia dialitica. Dal punto di vista cardiologico il paziente è portatore di una nota preeccitazione ventricolare asintomatica e di bicuspidia aortica isolata (Figura 1 e 2).
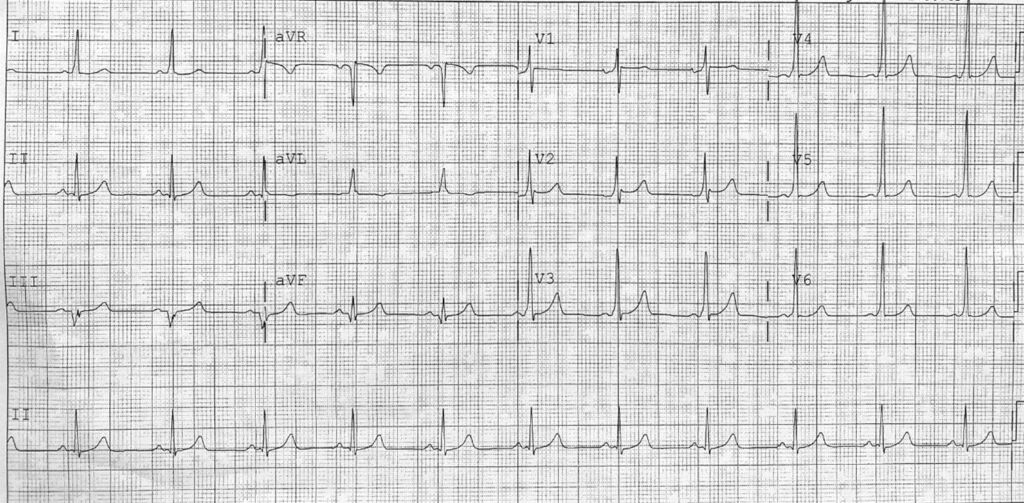
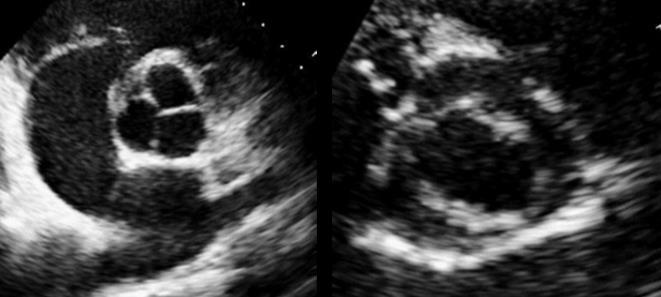
Fig 2: valvola aortica bicuspide in parasternale asse corto.
All’ingresso in reparto il paziente si presenta eupnoico in aria ambiente con PA 130/70 mmHg; SpO2 96% e una TC di 38,5 °C. L’esame obiettivo rivela crepitazioni bibasali all’auscultazione polmonare ed un soffio protodiastolico II/VI di nuovo riscontro. L’RX torace conferma la presenza di segni di congestione ilo-perilare ed agli esami di laboratorio si evidenzia una leucocitosi neutrofila (GB 15000/mmc con 77% di neutrofili) associata ad un rialzo di PCR e procalcitonina (rispettivamente 9 mg/dL e 4 ng/L). Viene intrapresa terapia antibiotica empirica con piperacillina/tazobactam successivamente sostituito con oxacillina e levofloxacina dopo il riscontro di emocolture positive per Staphylococcus lugdunensis.
Viene quindi eseguito un ecocardiogramma transesofageo con riscontro di vegetazione endocarditica su valvola aortica bicuspide con associato rigurgito di grado severo (figura 3).

Fig. 3: vegetazione endocarditica associata a rigurgito valvolare severo all’ecocardiogramma transesofageo.
Dopo discussione collegiale si pone indicazione ad intervento di sostituzione valvolare aortica con protesi meccanica, da eseguirsi dopo adeguato ciclo di terapia antibiotica. Seguono accertamenti radiologici (TC encefalo, angioTC dell’aorta toracica ed ecografia addomanale) che escludono ulteriori localizzazioni settiche e/o dilatazioni aneurismatiche dell’aorta toracica.
Il paziente è dunque sottoposto a intervento di sostituzione valvolare aortica in sternotomia parziale superiore con protesi meccanica Bicarbon 25 mm, con regolare decorso post-operatorio ed estubazione precoce, cui segue trasferimento in degenza cardiologica (in figura 4 la radiografia torace post intervento).
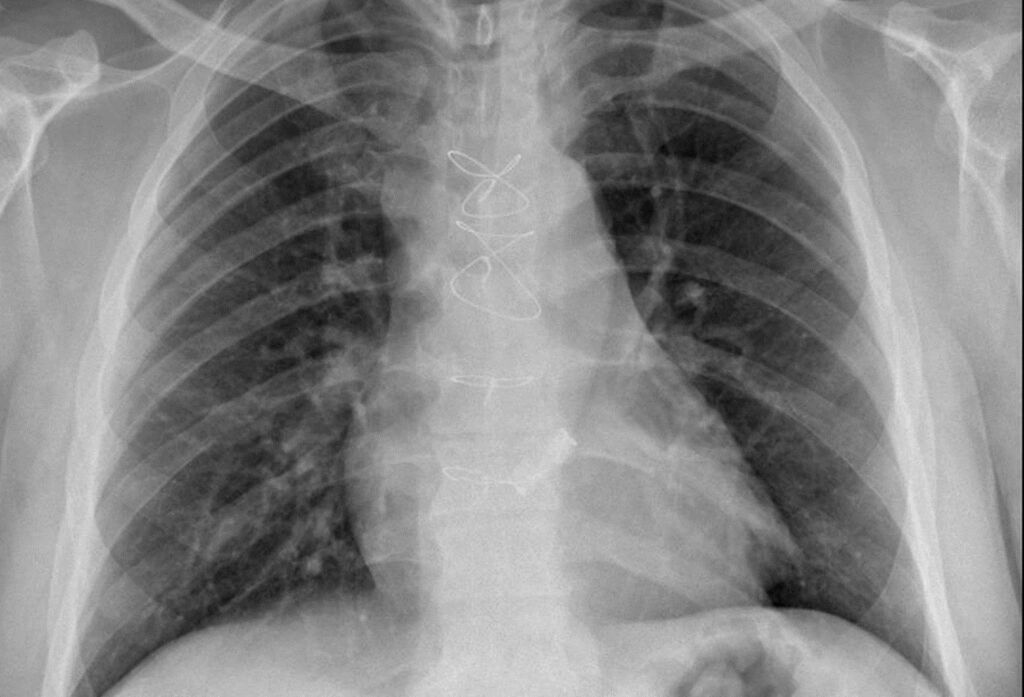
Fig 4: RX torace post-intervento cardiochirurgico di sostituzione valvolare con protesi meccanica.
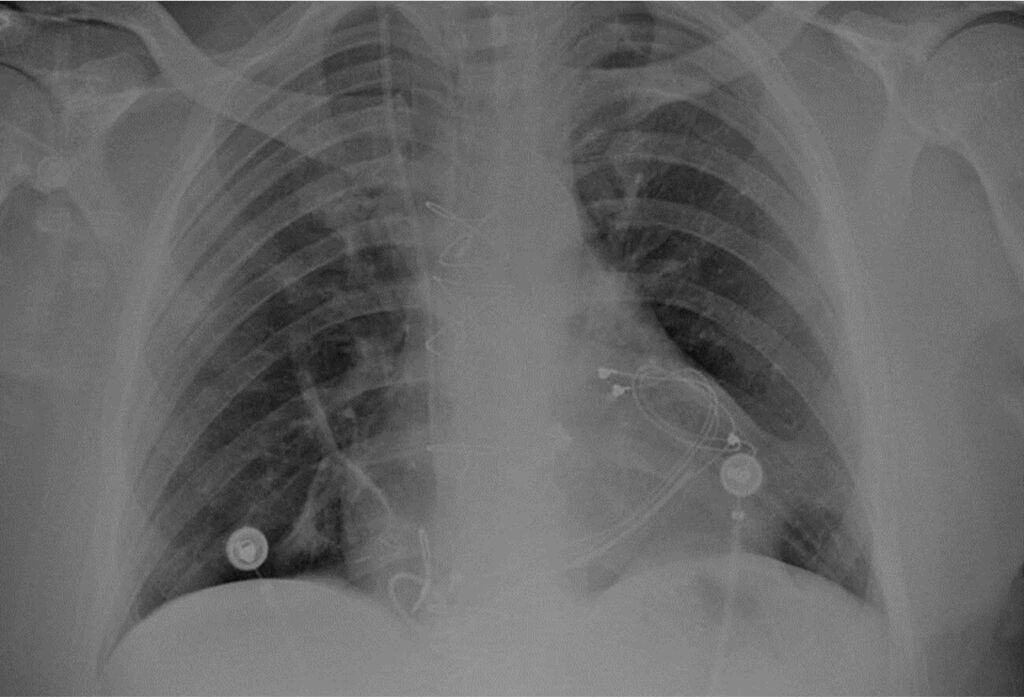
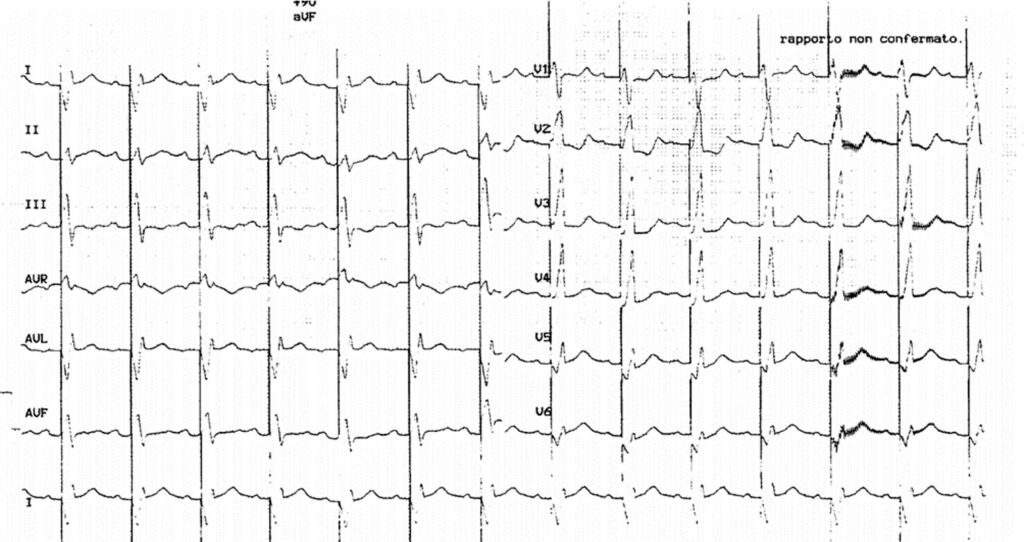
L’ecocardiogramma transtoracico post-intervento evidenzia una funzione sistolica biventricolare conservata e buon funzionamento della protesi meccanica bidisco. Tuttavia, l’osservazione dell’ECG post-operatorio mostra normale ritmo sinusale con complessi ventricolari slargati (Figura 5).

Fig 5: ECG post-operatorio.
In considerazione dell’anamnesi di preeccitazione ventricolare, il tracciato elettrocardiografico depone in prima ipotesi per una conduzione tra atrio e ventricolo tutta attraverso la via anomala.
Al fine di meglio stratificare la capacità conduttiva della via anomala il paziente viene avviato a studio elettrofisiologico, che conferma la presenza di via accessoria postero-laterale sinistra ad elevata capacità conduttiva anterograda (< 210 ms) e la contestuale assenza di conduzione attraverso la via nodale classica (ablata chirurgicamente durante l’intervento). Viene anche effettuato test farmacologico con flecainide al fine di valutare la possibilità di modulazione della conduzione attraverso la via anomala vista anche la facile inducibilità di fibrillazione atriale ed il rischio di sviluppare l’aritmia nel futuro. A bassissime dosi di flecainide si ha la comparsa di blocco completo della conduzione attraverso la via accessoria, con necessità di pacing ventricolare temporaneo per diversi minuti nel corso della procedura.
A questo punto le opzioni terapeutiche percorribili sono molteplici, ciascuna meritevole di specifiche considerazioni: innanzitutto si ritiene che la presenza di una via accessoria ad elevata conducibilità anterograda esponga il paziente ad un rischio inaccettabile in corso aritmie atriali (ed in particolare di fibrillazione atriale), per le quali il profilo di rischio lifetime è elevato (paziente giovane, in terapia dialitica per insufficienza renale cronica, già sottoposto ad intervento cardiochirurgico).
Per tali ragioni si opta per l’inibizione della via accessoria previo impianto di dispositivo di cardiostimolazione. La scelta del tipo di dispositivo non è banale: l’impianto di un dispositivo transvenoso classico configura un rischio infettivo proibitivo; un pacemaker leadless abbatterebbe tale rischio, ma comporterebbe una stimolazione non fisiologica (in paziente con percentuale di stimolazione attesa del 100%) e necessità in futuro di plurimi reimpianti all’esaurimento delle batterie; pertanto si decide l’impianto di un dispositivo bicamerale biventricolare (CRT-P) con elettrodi epicardici, allo scopo sia di ridurre il rischio infettivo sistemico e al contempo di garantire una stimolazione più simile a quella fisiologica rispetto ad una stimolazione esclusivamente ventricolare destra. L’intervento è stato eseguito mediante accesso minitoracotomico sinistro e il decorso post-operatorio è risultato privo di complicanze.

Data la sensibilità della via anomala a basse concentrazioni di antiaritmici di classe Ic documentata in corso di studio elettrofisiologico, nonché la volontà di ridurre le procedure invasive in un paziente già sottoposto a duplice intervento chirurgico nell’arco di pochi mesi, si decide di inibire farmacologicamente la via anomala con flecainide, iniziata efficacemente nel post-operatorio, rispetto all’ablazione transcatetere, che comunque rimane percorribile in futuro.
Al successivo follow-up a 6 mesi il paziente è stabilmente asintomatico, apiretico e in buon compenso, ed in particolare non sono documentati episodi aritmici da parte del dispositivo.
Discussione:
I disturbi di conduzione dopo chirurgia valvolare aortica o mitralica che richiedono impianto di Pacemaker (PM) definitivo sono relativamente frequenti ed interessano circa dal 4 al 13% del totale degli interventi, con tassi significativamente maggiori in caso di chirurgia combinata. I principali fattori di rischio preoperatori sono l’età avanzata, i disturbi di conduzione pre-esistenti (disfunzione del nodo del seno, blocchi atrioventricolari, blocchi fascicolari e disturbi aspecifici della conduzione intraventricolare), mentre comorbidità quali il diabete, bronchite cronica ostruttiva, insufficienza renale cronica e arteriopatia polidistrettuale sono fattori di rischio per impianto di PM entro un anno dalla chirurgia 1.
Il caso in oggetto offre diversi spunti di riflessione sia riguardo la “presentazione anomala” del blocco del nodo atrioventricolare, dovuta alla coesistente via accessoria, sia riguardo le difficoltà e le sfide nella gestione terapeutica di una situazione in cui è fondamentale non solo riflettere sul contesto clinico attuale ma anche prevedere e prevenire le possibili complicanze che si potranno verificare in futuro (tachiaritmie atriali, rimodellamento ventricolare avverso).
Come già anticipato nella descrizione del caso, le opzioni terapeutiche disponibili dopo la diagnosi di blocco atrioventricolare di III grado erano molteplici. D’altra parte non vi sono indicazioni specifiche nelle linee guida attuali adattabili al contesto specifico e sebbene il nostro paziente non presentasse un’indicazione codificata alla terapia di resincronizzazione (LVEF conservata ed anamnesi negativa per scompenso cardiaco) la strategia terapeutica è stata condizionata dalla volontà di prevenire un rimodellamento avverso con associato deterioramento della funzione ventricolare sinistra (Pacing Induced Cardiomyopathy) dovuti alla stimolazione ventricolare destra (percentuale di pacing attesa del 100%), nonché di evitare i rischi associati ad un eventuale upgrade del dispositivo qualora questa situazione si fosse verificata nel follow up.
Bibliografia
- Incidence and Risk Factors for Permanent Pacemaker Implantation Following Mitral or Aortic Valve Surgery. Moskowitz et al. JACC. 2019.
- Incidence and predictors of right ventricular pacing-induced cardiomyopathy. Khurshid et al. Heart Rhythm. 2014.
- 2021 ESC Guidelines on cardiac pacing and cardiac resynchronization therapy: Developed by the Task Force on cardiac pacing and cardiac resynchronization therapy of the European Society of Cardiology (ESC) With the special contribution of the European Heart Rhythm Association (EHRA). Glikson et al. EHJ. 2021.