Tutto bene, ma abbiamo un problema.
Quando vi chiamano per valutare Andrea (nome fittizio, maschio, 31 anni) in Pronto Soccorso, la prima impressione che ne avete è quella di un uomo in piena salute; capite subito che pratica sport regolarmente, e riconoscete dall’abbigliamento il nome di una famosa marca di prodotti tecnici per le attività outdoor.
Il Collega del Pronto Soccorso vi racconta il caso. Da un paio di settimane capita che Andrea lamenti una ridotta tolleranza allo sforzo ed episodi di intensa astenia; raramente avverte delle palpitazioni. La cosa è per lui insolita, visto che pratica escursionismo anche su lunghe distanze senza alcun disturbo; almeno fino agli eventi attuali.
Vi fate passare la cartella clinica, e prendete visione dei primi accertamenti (Box 1).

Il Collega di Pronto Soccorso non ha rilevato elementi di criticità, ma vuole un vostro parere: può mandare Andrea a casa?
I dati a vostra disposizione permettono di escludere sindromi acute di impatto prognostico a breve termine. Discutete dell’ipotesi Embolia Polmonare, ma concordate che la probabilità pre-test è troppo bassa; quando notate che il D-dimero è negativo archiviate del tutto la questione. Rivalutate l’elettrocardiogramma, che appare nella norma: il modesto prolungamento dell’intervallo PR potrebbe essere del tutto in linea con il fatto che il paziente è molto allenato.
Sembra tutto in ordine, ma la giovane età del paziente vi induce ad avere un atteggiamento prudenziale. D’accordo con il Collega, trattenete Andrea per ulteriori osservazioni.
Nelle 24h successive, gli esami del sangue si confermano nella norma, a parte quel BNP un po’ elevato. Cogliete l’occasione per un Ecocardiogramma, che si mostra nei limiti: non rilevate versamento pericardico o ipertensione polmonare; le valvole sono di normale morfologia e funzione; la vena cava è piccola e normo-modulata. Al mattino successivo viene ripetuto un Elettrocardiogramma, che vi portano in visione durante il briefing di reparto (Immagine 1).

Immagine 1. ECG standard, derivazioni periferiche.

Immagine 1, particolare. Ingrandimento di DII, dove meglio si apprezza il ritmo del paziente.
Il tracciato suscita il vostro interesse, dal momento che riconoscente un breve parossismo di dissociazione atrioventricolare, per Blocco Atrio Ventricolare Completo. Condividete la notizia con i Colleghi presenti. Che cosa fare?
Il riscontro di un BAV III pone davanti a una scelta clinica di significato prognostico: quando esso si presenti come espressione di danno o compromissione del sistema di conduzione, rappresenta una indicazione a impianto di pacemaker definitivo, al fine di prevenire la ricorrenza o l’incidenza di bradicardie severe di impatto emodinamico, o di aritmie ipercinetiche ventricolari bradicardia-dipendenti (in ogni caso, eventi a impatto clinico e prognostico significativo). Tuttavia, bisogna desistere dal risolvere nel pragmatismo terapeutico l’intero percorso diagnostico, rinunciando a comprendere la natura del disturbo. Le Linee Guida raccomandano di escludere cause reversibili di Blocco AV, in presenza delle quali il pacing definitivo non è indicato; tale raccomandazione vale ancora di più in presenza di un giovane di 31 anni, per il quale l’impianto inappropriato di un device potrebbe avere delle conseguenze significative (in termini di rischio infettivo a lungo termine, impatto psicologico e interferenza con le scelte lavorative).
Con le Linee Guida in testa, cercate di rifare una breve ricognizione delle cause alternative e reversibili di BAV. La lista è potenzialmente lunga, ma molte delle opzioni sarebbero auto-evidenti, se presenti. L’ipotesi infiltrativa (sarcoidosi, amiloidosi, emocromatosi) non è in linea con i rilievi ecocardiografici, strumentali e anamnestici del paziente; non sono presenti, inoltre, segni di malattie del collagene, o neuromuscolari. La chirurgia cardiaca è escludibile su base anamnestica. Vi soffermate un attimo sull’ipotesi del “physical training” (allenamento fisico), che pure si applicherebbe al caso di Andrea: l’idea di risolvere un BAV III con la sola ipotesi di un ipertono vagale da sport vi sembra però troppo audace, e comunque poco utile al fine della messa in sicurezza del paziente.
Proprio mentre pensate ad Andrea come sportivo, dedito all’escursionismo, passate al vaglio le ipotesi infettive e vi si accende una lampadina.
L’ipotesi Lyme
La Malattia di Lyme è una patologia infettiva causata dalla spirocheta Borrelia burgdorferi e veicolata dalle zecche del genere Ixodes: l’attività all’aperto in aree endemiche rappresenta un presupposto molto comune al contagio. Lo sviluppo iniziale della malattia consta di due fasi: una fase precoce localizzata, caratterizzata dal tipico eritema migrante che compare entro le 4 settimane dalla trasmissione, accompagnata da sintomi costituzionali; e la fase di disseminazione precoce, caratterizzata da interessamento dermatologico, articolare, neurologico e cardiaco (in proporzioni variabili in funzione della specie di Borrelia coinvolta). Le manifestazioni cliniche della Cardite sono variabili, e prevalgono nello 0.3 – 4% dei pazienti con Malattia di Lyme; circa il 90% dei casi di Cardite di Lyme presenta un blocco di AV. Oltre al disturbo di conduzione, si riconoscono come manifestazioni anche la miocardite e la pericardite, sebbene più rare.
La diagnosi di malattia di Lyme con interessamento cardiaco si avvale soprattutto dello strumento del sospetto: le manifestazioni sistemiche sono infatti tutt’altro che patognomoniche; uno dei segni più caratteristici, l’eritema migrante, spesso è assente al momento della prima valutazione medica/cardiologica.
Una possibile guida nel sospetto clinico può derivare dal SILC score, che è stato proposto allo scopo di stratificare la probabilità che un paziente con disturbo della conduzione atrio-ventricolare abbia malattia di Lyme. Tale score non fa altro che raccogliere gli elementi anamnestici più caratteristici (morso di zecca, esposizione a un possibile reservoire ambientale), le manifestazioni cliniche più peculiari (tra tutte: l’eritema migrante), in un contesto in cui l’ipotesi degenerativa non spieghi adeguatamente il disturbo di conduzione (età < 50 anni). E’ quindi soprattutto un invito, davanti a un BAV avanzato in un soggetto giovane, a … prendersi una pausa per pensarci, e a indirizzare a ulteriori approfondimenti i pazienti con score di rischio intermedio-alto. Comunque, nulla che non si possa fare con una buona consapevolezza della malattia.
Dall’ipotesi ai fatti.
Riparlando con Andrea, cercate di approfondire l’anamnesi, e di ricavare dei dati validi in favore del vostro sospetto. Insistendo, scoprite che qualche tempo prima c’è stato effettivamente un morso di zecca: il paziente non ve ne ha parlato, considerandolo un banale “rischio del mestiere”, essendo un appassionato frequentatore dei boschi, attivamente dedito all’escursionismo. Ripetete un esame della cute, senza rilievi; tuttavia, quando mostrate ad Andrea una foto di eritema migrante, egli riconosce di avere avuto qualcosa di simile. Il cerchio si stringe: contattate l’Infettivologo e con la sua guida impostate una diagnostica sierologica.

Box 2. Elementi del Suspicious Index in Lyme Carditis; stratificazione dello score in Basso, Intermedio e Alto rischio.
Parallelamente, visto il forte sospetto clinico, iniziate la terapia antibiotica specifica: tra i regimi suggeriti, impostate su consiglio specialistico un protocollo di Ceftriaxone 2 gr/die, da passare dopo 10 giorni a Doxiciclina 100mg bid. La risposta della sierologia vi conferma nella vostra scelta: si tratta di un caso di Malattia di Lyme con coinvolgimento cardiaco.
Siete soddisfatti del vostro percorso diagnostico, e condividete con Andrea l’interessante scoperta. Lui accoglie la notizia contagiato dal vostro entusiasmo, ma alla fine vi confessa che non ha ben capito: adesso che sappiamo che si tratta di Cardite di Lyme, cosa facciamo?
Fisiopatologia e gestione pratica.
La dinamica alla base dell’interferenza con il funzionamento del sistema di conduzione cardiaco, nella Cardite di Lyme, è solo in parte chiara. Da un lato, è riconosciuto un organotropismo (potenzialmente mediato dalle selectine di membrana), con ipotizzata affinità per il metabolismo glico-dipendente del miocardio specializzato, rispetto a quello lipo-dipendente del miocardio di lavoro. Del resto, sono noti anche casi in cui non è stato possibile rilevare la presenza della spirocheta nel tessuto di conduzione, dando spazio a ipotesi di danno immuno-mediato per mimetismo molecolare.
Quale che sia il meccanismo alla base, la gestione del paziente con Cardite di Lyme deve bilanciare due aspetti: la sicurezza del paziente, che va protetto in fase precoce e tardiva da bradiaritmie di significato emodinamico o prognostico, e la consapevolezza della reversibilità della malattia, in particolare in quei casi con precoce intervento terapeutico.
Uno strumento di primo livello è sicuramente il monitoraggio telemetrico in reparti dedicati, che valuti la regressione del disturbo di conduzione durante i primi giorni di malattia. Il mancato recupero nei primi 14 giorni di solito suggerisce il ricorso a pacing definitivo. In caso di regressione del disturbo, è consigliato valutare con un test provocativo da sforzo le proprietà dromotrope del sistema di conduzione, con verifica del punto Wenckebach (Immagine 2).

Immagine 2. Possibile percorso decisionale nella scelta pacing si/pacing no.
Lieto fine
Il recupero di Andrea in corso di terapia è totale: non solo non ricorrono episodi di BAV avanzato, ma il PR stesso si normalizza. In telemetria apprezzate una buona competenza cronotropa già per gli spostamenti in reparto, così decidete di archiviare l’ipotesi pacing e di procedere con un test ergometrico a due settimane dal ricovero. In vista della dimissione a domicilio, per aumentare il potere di accuratezza diagnostica per recidive aritmiche, decidete per l’impianto di un LoopRecorder. Non tutti i vostri Colleghi sono d’accordo, voi accettate di andare controcorrente e, come a volte accade nella pratica clinica di ciascuno di noi, vi coincidete questa scelta di “tranquillità”, dopo aver condiviso la decisione con il paziente.
E’ giunto il giorno della dimissione. Vi prendete il tempo di spiegare ad Andrea il significato di quello che è successo, la prosecuzione della terapia antibiotica a domicilio, e il programma dei controlli. Il paziente, visibilmente felice, vi saluta ringraziandovi e chiosando: “Dopo tutto questo, giuro che la prossima volta vado al mare!”
I Controlli
Il programma di follow-up che avete impostato comprende due esami, i cui risultati sono confortanti.
1) Test da Sforzo al Cicloergometro: (referto): “E’ stato effettuato test da sforzo al cicloergometro con incrementi di 25 x 2 Watt ogni 2 minuti. L’esame è stato interrotto a 125 watt per affaticamento muscolare (FC max 189bpm, PA max 190/90mmHg, con doppio prodotto di 35.910)”. L’ECG del test è quello in Immagine 3.

Immagine 3. Test ergometrico, tracciati al basale e all’acme del test.
2) Cine RMN Cuore: Come vi aspettavate, non ci sono dati significativi. La Cardite non ha determinato danno miocardico permanente (Immagine 4): si le sequenze di edema che quelle di LGE sono normali.
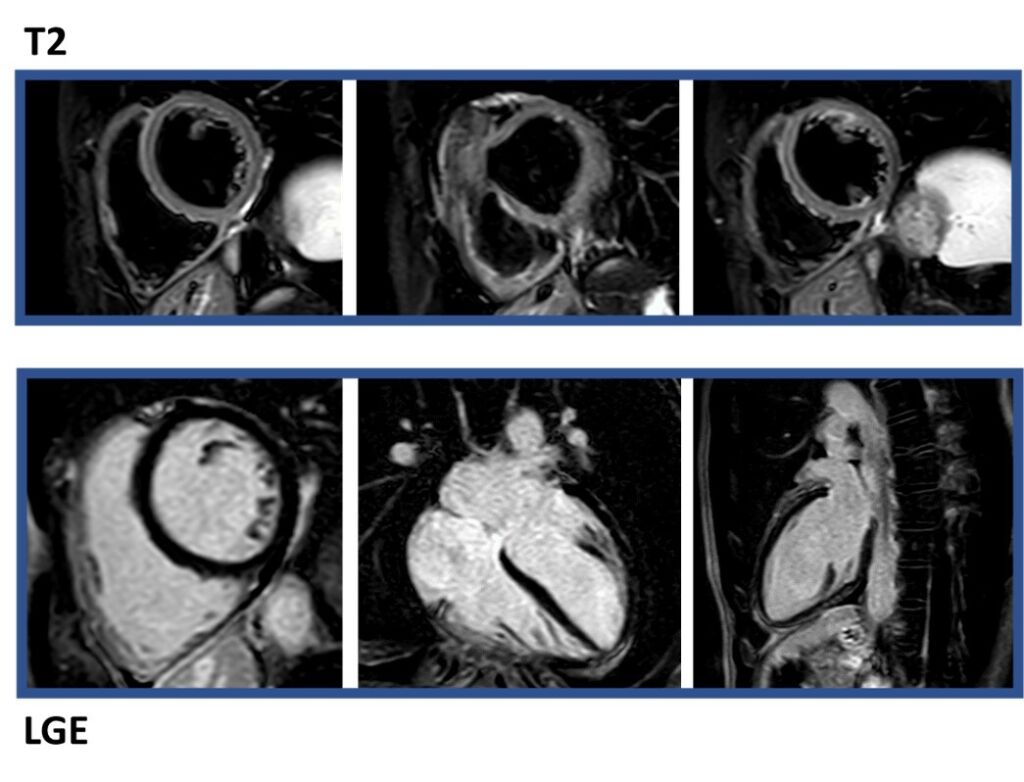
Immagine 4. Cine RMN Cuore con Mezzo di Contrasto: T2 e LGE negativi.
Il saluto di Andrea.
Alla visita di follow-up a due mesi, Andrea sta bene. Non ha più quei preoccupanti episodi di affanno e si sente in piena forma. Ha anche ripreso a fare escursionismo.
“E il mare?” gli chiedete. “Per il mare non è stagione”, vi risponde Andrea, “e poi, cammino meglio di come nuoto”.
Bibliografia:
1)Yeung C, Baranchuk A. Diagnosis and Treatment of Lyme Carditis: JACC Review Topic of the Week. J Am Coll Cardiol. 2019 Feb 19;73(6):717-726. doi: 10.1016/j.jacc.2018.11.035. Erratum in: J Am Coll Cardiol. 2019 Nov 26;74(21):2709-2711. PMID: 30765038.
2) Radesich C, Del Mestre E, Medo K, Vitrella G, Manca P, Chiatto M, Castrichini M, Sinagra G. Lyme Carditis: From Pathophysiology to Clinical Management. Pathogens. 2022 May 15;11(5):582. doi: 10.3390/pathogens11050582. PMID: 35631104; PMCID: PMC9145515.
3) Glikson M, Nielsen JC, Kronborg MB, Michowitz Y, Auricchio A, Barbash IM, Barrabés JA, Boriani G, Braunschweig F, Brignole M, Burri H, Coats AJS, Deharo JC, Delgado V, Diller GP, Israel CW, Keren A, Knops RE, Kotecha D, Leclercq C, Merkely B, Starck C, Thylén I, Tolosana JM; ESC Scientific Document Group. 2021 ESC Guidelines on cardiac pacing and cardiac resynchronization therapy. Eur Heart J. 2021 Sep 14;42(35):3427-3520. doi: 10.1093/eurheartj/ehab364. Erratum in: Eur Heart J. 2022 May 1;43(17):1651. PMID: 34455430.