Il paziente
Nel Gennaio 2020 è riferito presso l’Ambulatorio Scompenso Cardiaco e Cardiomiopatie per presa in carico un uomo di 72 anni con Cardiomiopatia Ipertrofica (CMPI) non ostruttiva a funzione sistolica normale diagnosticata nel 2011, portatore di ICD in prevenzione primaria dal 2016 (mai interventi) per extrasistolia ventricolare frequente e brevi run di tachicardia ventricolare non sostenuta (5-y HCM-SCD Risk Score > 6%).
In anamnesi riferiva familiarità per cardiopatia ischemica non precoce (un fratello con pregresso CABG, due fratelli trattati con angioplastica primaria per SCA), ipertensione arteriosa, BPCO moderata, FA persistente in rate control con beta bloccante dopo multiple CVE e numerosi tentativi di controllo farmacologico (propafenone, dronedarone e sotalolo) e pregresso ipertiroidismo da amiodarone con noduli tiroidei in follow-up endocrinologico.
Nel Marzo 2018 era stato ricoverato per primo episodio di scompenso cardiaco in corso di flutter atriale ad elevata conduzione AV interrotto con CVE e ripristino di ritmo sinusale. Il referto dell’ecocardiogramma in dimissione descriveva un ventricolo sinistro di normali dimensioni, con nota ipertrofia concentrica (SIV 24 mm, PP 20 mm), normale funzione sistolica biventricolare (FEVSin 50%, FACC VDx 55%), insufficienza mitralica di grado lieve, moderata dilatazione biatriale e minimo versamento pericardico circonferenziale di nuovo riscontro.
Nel mese di gennaio 2020, il paziente si presenta con scompenso cardiaco in classe NYHA III, segni minori di congestione periferica, peso stabile (58 Kg) negli ultimi mesi, BNP 575 pg/ml, troponina hs 64 ng/l, PA 105/65 mmHg (clinostatismo). Riduzione della capacità funzionale (6MWT 370 mt in piano). Mai episodi sincopali. Ha interrotto da alcuni mesi la terapia anti-ipertensiva per astenia. La terapia cardiologica domiciliare consta di apixaban 5 mg bid, bisoprololo 7.5 mg, digitale 0.250 mcg e furosemide 25 mg/die.
Il suo tracciato elettrocardiografico (Figura 1) mostra un flutter atriale normofrequente con occasionali ventricologrammi elettroindotti, blocco di branca sinistra con alterazioni secondarie della ripolarizzazione, voltaggi del QRS discretamente rappresentati in sede precordiale, meno in sede periferica (primo e secondo QRS non elettroindotti).

L’ecocardiogramma si connota per diffusa ipertrofia concentrica ventricolare sinistra con coinvolgimento della parete libera del ventricolo destro in presenza di ipertensione arteriosa polmonare moderata, pattern diastolico restrittivo, trama miocardica eterogenea, ispessimento del setto interatriale e delle valvole atrioventricolari, versamento pericardico minore (Figura 2).

Le informazioni raccolte spingono ad approfondire l’anamnesi non cardiologica e alla rivalutazione dei dati disponibili. Il Paziente riferisce un intervento per sindrome del tunnel carpale bilaterale nel 1992 con sintomatologia neuropatica persistente e segni di sofferenza ad un elettromiografia di 4 mesi prima e la recente insorgenza di disfonia persistente. Inoltre, l’ipertrofia importante del ventricolo sinistro non si esprime in un incremento dei voltaggi QRS nelle derivazioni periferiche. La revisione dei tracciati elettrocardiografici del 2011 in corso di ritmo sinusale mostrava già all’epoca un blocco atrio-ventricolare di I grado ed il blocco di branca sinistra, disturbi non tipici del modello della CMPI.
Nel sospetto di amiloidosi cardiaca (AC) si eseguono le indagini previste dall’algoritmo di Gillmore per la diagnosi non invasiva di malattia (Figura 3).
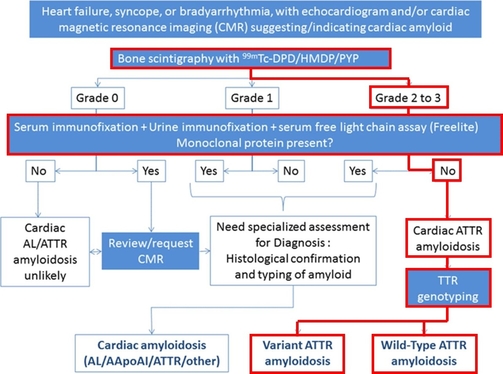
Il Paziente esegue la ricerca di componente monoclonale nel siero e delle urine, risultata assente, ed una scintigrafia cardiaca con pirofosfato che documenta un intenso accumulo del tracciante nel cuore (Perugini Grado 3) (Figura 4). Il Paziente riceve la diagnosi di amiloidosi cardiaca da accumulo di transtiretina ed esegue il prelievo per l’analisi genetica1.

La terapia con digitale è interrotta e quella con bisoprololo rimodulata alla dose di 2.5 mg/die.
Nel Febbraio 2020 l’analisi del gene della transtiretina non identifica mutazioni e si attiva il programma di “uso compassionevole” del Tafamidis2.
Al controllo cardiologico eseguito nel maggio 2020 il Paziente riferisce un miglioramento soggettivo dopo la riduzione della terapia betabloccante. Per edemi declivi si incrementa la terapia diuretica con furosemide 75 mg/die e si inizia Tafamidis.
Un nuovo controllo è stato eseguito nel mese di gennaio 2021: il Paziente ha uno scompenso cardiaco stabile in classe NYHA II, Peso 56 Kg, BNP 415 pg/mL, PA 90-95/60 mmHg. Non sintomi da ipotensione ortostatica. 6MWT 460 mt. Non interventi dell’ICD.
Take Home Message
- Un approccio epidemiologico alle cause di ipertrofia cardiaca: il Paziente ha ricevuto la diagnosi di CMPI a 64 anni. La CMPI è una malattia prevalente < 60 anni, ma oltre questa età la frequenza delle fenocopie incrementa significativamente. Si è stimato che il 5% delle CMPI sono in realtà amiloidosi cardiache misconosciute3;
- Red flags di amiloidosi cardiaca: diverse red flags cliniche ed ecocardiografiche erano evidenti al momento della presentazione come lo scompenso cardiaco a funzione sistolica preservata (contesto ad elevato sospetto per AC4), l’incremento significativo di BNP rispetto al grado di congestione, la discrepanza tra ipertrofia cardiaca e voltaggi periferici del QRS5, la recente disfonia, le red flags ecocardiografiche6. Tuttavia, vi erano forti elementi di sospetto per AC già nel 2011, quando ricevette la diagnosi di CMPI. Allora il Paziente aveva eseguito 19 anni prima un intervento per sindrome del tunnel carpale bilaterale7, una importante red flag clinica in grado di precedere di anni la diagnosi di AC, come avvenuto in questo caso8. Un elemento ulteriore di riflessione è legato alla persistenza della sofferenza neuropatica del nervo mediano (documentata all’elettromiografia) dopo l’operazione che pone il sospetto di un meccanismo di neuropatia differente dalla compressione ab estrinseco del nervo;
- FA e strategia rate-control: l’aritmia persistente e recidivante nonostante CVE e multipli AADs è un evento frequente nella AC ed ha portato ad una strategia di rate control9. Tuttavia, la digitale è un farmaco da evitare in questa patologia per il potenziale di tossicità cardiaca10 e il beta bloccante richiede una modulazione lenta e progressiva sulla base dello stato clinico e della pressione arteriosa. Nel nostro Paziente l’AC si è manifestata come vera CMP restrittiva11 rispondente ad un modello di malattia con una gittata frequenza-dipendente. Pertanto, la bradicardia indotta dall’alta dose del beta bloccante era emodinamicamente mal tollerata;
- Rischio aritmico: il Paziente ha ricevuto l’impianto di un defibrillatore permanente per un rischio di morte aritmica stimato elevato. Rispetto alla CMPI, l’AC è una cardiomiopatia con un rischio aritmico significativamente inferiore in cui lo score ESC HCM non è validato per la stratificazione del rischio di della morte aritmica a 5 anni. La formulazione di una diagnosi corretta nel 2011 avrebbe portato a riconsiderare l’impianto del device;
- Rischio ischemico: la diagnosi di AC non deve rendere meno incisivi nella valutazione del profilo ischemico. La malattia coronarica spesso coesiste in questi pazienti di età avanzata (>70 anni) e pluricomorbidi;
- Terapia eziologica: la disponibilità di terapie disease-modifying come il Tafamidis e le nuove molecole in corso di studio6,12 rende cruciale il raggiungimento di una diagnosi precoce, laddove l’accumulo cardiaco di amiloide è minore ed i benefici attesi dalla terapia su miglioramento dello stato funzionale e sopravvivenza globale sono maggiori.
CONFLITTI D’INTERESSE
Nessuno
RINGRAZIAMENTI
Ringrazio il mio Maestro, Prof. Gianfranco Sinagra, ed il Prof. Marco Merlo per la disponibilità continua al confronto critico e al supporto nella gestione clinica dei Pazienti complessi con amiloidosi cardiaca.
Ringrazio la Prof.ssa Franca Dore ed tutti i Colleghi del Dipartimento di Medicina Nucleare dell’Ospedale di Cattinara, ASUGI, Trieste, per la preziosa collaborazione con il Dipartimento Cardiovascolare e l’impegno quotidiano nei percorsi diagnostici dei Pazienti con sospetta amiloidosi cardiaca.
Ringrazio il Prof. Francesco Prati e la Dr.ssa Laura Gatto per la possibilità di divulgare il presente caso clinico.
Bibliografia
- Gillmore, J. D. et al. Nonbiopsy Diagnosis of Cardiac Transthyretin Amyloidosis. Circulation 133, 2404–2412 (2016).
- Maurer, M. S. et al. Tafamidis Treatment for Patients with Transthyretin Amyloid Cardiomyopathy. N. Engl. J. Med. 379, 1007–1016 (2018).
- Damy, T. et al. Prevalence and clinical phenotype of hereditary transthyretin amyloid cardiomyopathy in patients with increased left ventricular wall thickness. Eur. Heart J. 37, 1826–1834 (2016).
- Mohammed, S. F. et al. Left Ventricular Amyloid Deposition in Patients With Heart Failure and Preserved Ejection Fraction. JACC Hear. Fail. 2, 113–122 (2014).
- Rapezzi, C. et al. Cardiac amyloidosis: the great pretender. Heart Fail. Rev. 20, 117–124 (2015).
- Porcari, A., Merlo, M., Rapezzi, C. & Sinagra, G. Transthyretin amyloid cardiomyopathy: An uncharted territory awaiting discovery. Eur. J. Intern. Med. 82, 7–15 (2020).
- Sperry, B. W. et al. Tenosynovial and Cardiac Amyloidosis in Patients Undergoing Carpal Tunnel Release. J. Am. Coll. Cardiol. 72, 2040–2050 (2018).
- Milandri, A. et al. Carpal tunnel syndrome in cardiac amyloidosis: implications for early diagnosis and prognostic role across the spectrum of aetiologies. Eur. J. Heart Fail. 22, 507–515 (2020).
- Giancaterino, S., Urey, M. A., Darden, D. & Hsu, J. C. Management of Arrhythmias in Cardiac Amyloidosis. JACC: Clinical Electrophysiology (2020). doi:10.1016/j.jacep.2020.01.004
- Donnelly, J. P. et al. Digoxin Use in Cardiac Amyloidosis. Am. J. Cardiol. 133, 134–138 (2020).
- Elliott, P. et al. Classification of the cardiomyopathies: a position statement from the European Society Of Cardiology Working Group on Myocardial and Pericardial Diseases. Eur. Heart J. 29, 270–6 (2008).
- Emdin, M. et al. Treatment of cardiac transthyretin amyloidosis: an update. Eur. Heart J. 40, 3699–3706 (2019).