Un uomo di 75 anni si presenta in Pronto Soccorso per dolore toracico tipico, sotto sforzo. In anamnesi patologica remota si riporta un pregresso carcinoma uroteliale di alto grado della vescica, trattato con cistectomia radicale, linfoadenectomia e confezionamento di neovescica, complicato da conseguente insufficienza renale cronica. Eseguiva regolari controlli urologici risultati sempre negativi per recidiva di malattia, con riscontro esclusivamente di un’anemia iporigenerativa trattata successivamente con eritropoietina. Dal punto di vista cardiologico, il paziente presentava alcuni fattori di rischio cardiovascolare, tra cui ipertensione arteriosa sistemica, ipercolesterolemia e abitudine tabagica, senza evidenza di precedenti problematiche cardiologiche di rilievo; tutti gli ECG di controllo eseguiti in precedenza risultavano nella norma.
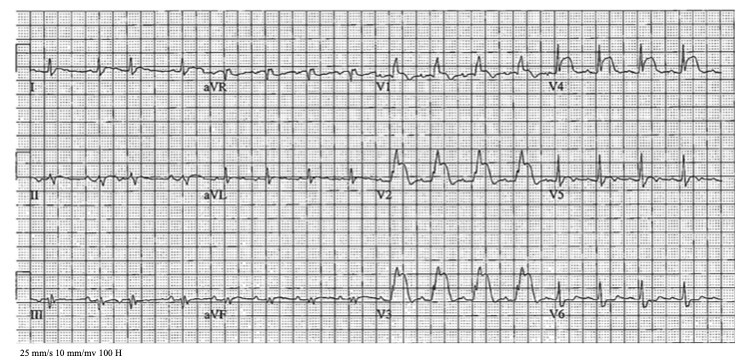
All’arrivo in Pronto Soccorso i parametri vitali così come gli esami ematochimici classici risultavano nella norma e anche l’esame obiettivo non mostrava segni rilevanti. Veniva, inoltre, eseguito un elettrocardiogramma a 12 derivazioni (Figura 1), che evidenziava un blocco di branca destra e un sopraslivellamento del tratto ST nelle derivazioni antero-settali, senza reciproco sottoslivellamento nelle derivazioni inferiori. Anche se non tipiche, queste alterazioni elettrocardiografiche suggeriscono un’ischemia transmurale ed è pertanto mandatorio escludere una sindrome coronarica acuta ostruttiva.
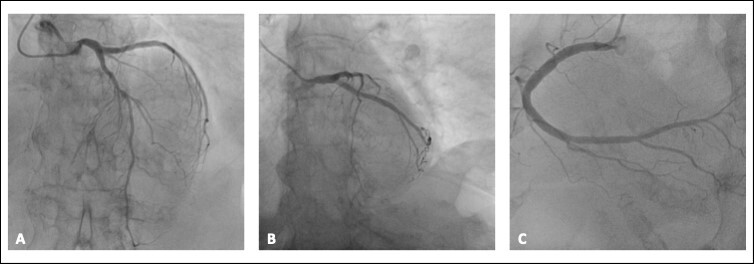
Per questo motivo, il paziente è stato condotto in urgenza in sala di emodinamica dove veniva eseguito lo studio coronarografico (Figura 2), con riscontro di coronarie indenni da lesioni angiograficamente significative. A questo si aggiungeva la presenza di una curva troponinica a 0-3 ore positiva (285 – 374 ng/L con range di normalità <40 ng/L).
Dunque, alla luce del quadro sintomatologico, elettrocardiografico, laboratoristico e coronografico, la diagnosi propendeva per un infarto miocardico acuto a coronarie indenni (MINOCA), ma è sempre importante sottolineare come la diagnosi di MINOCA rappresenti una cosiddetta “working diagnosis”, motivo per il quale è stato necessario proseguire l’iter diagnostico-terapeutico del paziente per escludere altre cause alternative.
Il paziente veniva ricoverato in Terapia Intensiva Cardiologica per il successivo iter. Agli ECG seriati eseguiti nei giorni successivi non si evidenziavano modifiche della ripolarizzazione ventricolare, con la persistenza del sopraslivellamento del tratto ST. Si eseguiva un primo ecocardiogramma al letto del paziente che mostrava un ventricolo sinistro di normali volumi e lieve ipertrofia a livello dell’apice e del setto interventricolare anteriore, con acinesia dell’apice e del SIV, una FE del ventricolo sinistro moderatamente ridotta, un ventricolo destro mal visualizzabile e l’assenza di versamento pericardico. Seguendo quelle che sono le attuali linee guida ESC 2020 sul MINOCA, per poter eseguire una corretta valutazione diagnostica è utile l’utilizzo dell’algoritmo a semaforo, in cui dopo aver effettuato lo studio coronarografico e l’ecocardiogramma, bisogna escludere le cause non ischemiche del rialzo degli indici di necrosi quali l’embolia polmonare o la dissezione aortica tramite un angioTC. Tale algoritmo propone, inoltre, di eseguire una RMN cardiaca per distinguere cause a pattern ischemico e non ed eventualmente in corso di esame coronarografico eseguire un imaging intravascolare o dei test funzionali utili soprattutto per definire la causa sottostante di un vero MINOCA.
Per questo motivo anche il nostro paziente è stato sottoposto ad un’angioTC polmonare che escludeva difetti di riempimento in arteria polmonare e nelle sue diramazioni. Successivamente veniva effettuata la risonanza magnetica cardiaca che ha rilevato la presenza di una massa eterogenea con un’area di necrosi centrale, localizzata all’apice del ventricolo destro infiltrante il pericardio e il setto interventricolare apicale. La massa appariva alle sequenze T2-pesate marcatamente iperintensa e dopo somministrazione di gadolinio la lesione risultava disomogenamente perfusa con evidenza di LGE (Figura 3). Tutte queste caratteristiche sono tipiche di lesioni maligne.
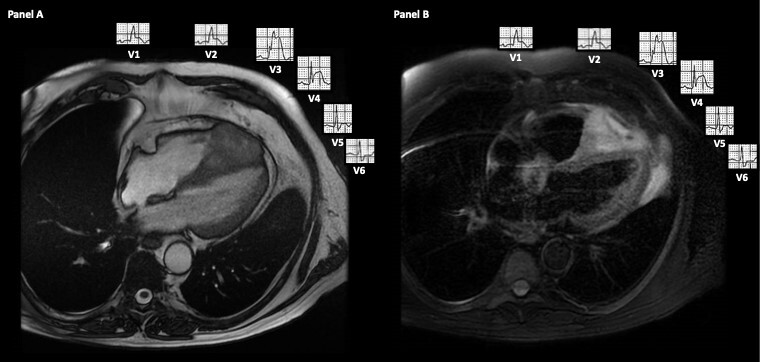
A. The Steady-state free precession (SSFP) 4-chamber sequence
B. The T2 weighted spectral inversion recovery (T2-SPIR)
Per completare la valutazione diagnostica radiologica, è stata eseguita una PET con FDG che ha confermato la presenza di un elevato gradiente di fissazione del radiotracciante a livello della nota massa cardiaca, con un SUV max di 10. Infine, è stata eseguita la biopsia transcatetere che ha permesso di fare diagnosi definitiva di metastasi di carcinoma uroteliale di alto grado.
Dunque, i ritrovamenti elettrocardiografici riscontrati e attribuiti in un primo momento ad un’ischemia miocardica, erano in realtà ascrivibili alla presenza di una massa metastatica infiltrante in maniera trasmurale il setto interventricolare apicale e l’apice del ventricolo destro. Come mostrato in Figura 3 le alterazioni elettrocardiografiche presenti erano giustificate dalla presenza della massa cardiaca; infatti, infiltrando il setto interventricolare veniva coinvolta la branca di destra determinando il blocco di branca e invadendo in maniera transmurale il setto interventricolare apicale mimava perfettamente uno STEMI anteriore. Un elemento chiave che in questo caso avrebbe potuto indirizzare verso una causa non ischemica è l’assenza all’elettrocardiogramma di un reciproco sottoslivellamento del tratto ST e di una mancata evoluzione delle modifiche della ripolarizzazione ventricolare negli elettrocardiogrammi successivi. Infatti, la presenza delle alterazioni reciproche incrementa di oltre il 90% il VPP per la diagnosi di infarto miocardico acuto, anche se questa reciprocità può venire a mancare in alcuni casi eccezionali come in caso di occlusione del ramo interventricolare anteriore distale.
È importante sottolineare che i tumori cardiaci sono molto rari e quelli primitivi ancor di più di quelli secondari. Vi possono essere tumori che crescono lentamente e vengono riscontrati solo accidentalmente, mentre altri si possono presentare sottoforma di vari sintomi, quali ostruzione del tratto di efflusso con segni di scompenso cardiaco, invasione diretta del tessuto di conduzione determinante aritmie, embolizzazioni in varie parti del corpo. Come anche il caso clinico in questione, in letteratura esistono pochi case reports di pazienti con masse cardiache che si presentano con elevazione del tratto ST e la maggior parte di questi presentano un pregresso carcinoma in altre aree del corpo.
Giunti, dunque, alla diagnosi definitiva il paziente è stato trasferito al reparto di Oncologia. Durante l’ospedalizzazione ha sviluppato una bronchite acuta, verosimilmente correlata ad un’infezione da S.Epidermidis, adeguatamente trattata con terapia antibiotica mirata e successiva insufficienza renale acuta su cronica. Il paziente veniva dimesso in singola terapia antiaggregante, dato l’alto rischio di sanguinamento del tumore e alla luce dell’alto rischio chirurgico, è stato candidato a solo trattamento radioterapico palliativo. Sfortunatamente è andato incontro ad exitus sei mesi dopo.
Possiamo dunque concludere che questo caso clinico sottolinei come un’alterazione elettrocardiografica può essere spia di un problema cardiaco strutturale piuttosto che di una più comune malattia cardiaca ischemica. Esistono diverse condizioni non ischemiche che possono portare ad un sopraslivellamento del tratto ST all’ECG a 12 derivazioni quali la pericardite acuta, l’iperkalemia, la sindrome di Brugada, la sindrome di Takostubo o le cardiomiopatie aritmogena e ipertrofica. Sicuramente la ricerca di alterazioni reciproche all’ECG rappresenta un utile strumento che permette di orientarsi verso una diagnosi di natura ischemica. Comunque, quando ci si trova di fronte a un paziente con diagnosi di MINOCA è necessario seguire un algoritmo specifico con l’intento di escludere altre cause possibili o fare diagnosi di vero MINOCA; tra tutti gli esami radiologici e di imaging la RMN cardiaca rimane l’esame cardine che permette di distinguere tra cause ischemiche e non. Ed infine, per quanto riguarda la curva troponinica positiva, essa può essere giustificata dal danno miocitario o dalla disfunzione microvascolare coronarica data dalla massa. Un altro possibile meccanismo fisiopatologico potrebbe essere l’infiltrazione diretta delle coronarie, ma non è il caso del paziente in questione.
BIBLIOGRAFIA
- Bueno H, Bugiardini R, Byrne RA, Castelletti S, Chieffo A, Cornelissen V, Crea F, Delgado V, Drexel H, Gierlotka M, Halvorsen S, Haugaa KH, Jankowska EA, Katus HA, Kinnaird T, Kluin J, Kunadian V, Landmesser U, Leclercq C, Lettino M, Meinila L, Mylotte D, Ndrepepa G, Omerovic E, Pedretti RFE, Petersen SE, Petronio AS, Pontone G, Popescu BA, Potpara T, Ray KK, Luciano F, Richter DJ, Shlyakhto E, Simpson IA, Sousa-Uva M, Storey RF, Touyz RM, Valgimigli M, Vranckx P, Yeh RW, Barbato E, Barthélémy O, Bauersachs J, Bhatt DL, Dendale P, Dorobantu M, Edvardsen T, Folliguet T, Gale CP, Gilard M, Jobs A, Jüni P, Lambrinou E, Lewis BS, Mehilli J, Meliga E, Merkely B, Mueller C, Roffi M, Rutten FH, Sibbing D, Siontis GCM. 2020 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation. European Heart Journal. 2021;42:1289–1367.
- Pollehn T. The electrocardiographic differential diagnosis of ST segment depression. Emergency Medicine Journal. 2002;19:129–135.
- Xiang K, Bhave PD, Whalen SP, Singleton MJ. Cardiac Tumor Masquerading as ST Elevation Myocardial Infarction: A Case Report and Literature Review. 2021;8.
- Bertil Lindahl, Tomasz Baron, Mario Albertucci, Francesco Prati. Myocardial infarction with non-obstructive coronary artery disease. EuroIntervention 2021;17:e875–e887.