Durante una lezione universitaria, una professoressa di 70 anni presenta un arresto cardiaco. Vengono prontamente eseguite le manovre rianimatorie, con ROSC dopo 2 DC shock su fibrillazione ventricolare e immediato recupero emodinamico e neurologico. La paziente è quindi trasferita presso la Terapia Intensiva Cardiologica per eseguire gli accertamenti del caso.
L’anamnesi evidenzia, come unico fattore di rischio, una dislipidemia mista in terapia con Atorvastatina. Non familiarità per morte cardiaca improvvisa né cardiomiopatie. Tra le comorbidità di rilievo, emicrania con aura e recente immobilizzazione per traumatismo della caviglia sinistra. L’anamnesi cardiologica è muta, eccetto un prolasso della valvola mitrale noto da anni, in assenza di sintomatologia, in particolare mai angina pectoris, cardiopalmo o sincope precedentemente al ricovero.
I parametri vitali all’ingresso sono stabili, l’obiettività non mostra reperti di rilievo.
All’ECG (figura 1) evidenza di ritmo sinusale, FC 75 bpm, alcuni battiti ectopici ventricolari isolati, normale conduzione atrioventricolare, scarsa progressione dell’onda R nelle derivazioni precordiali, alterazioni della ripolarizzazione (onde T negative) nelle derivazioni inferiori, QTc lievemente aumentato.

L’ecocardioscopia bedside mostra un ventricolo sinistro di normali dimensioni e volumi con cinetica globale e segmentaria conservata, sezioni destre nei limiti, prolasso della valvola mitrale, assenza di versamento pericardico.
Gli esami ematochimici sono nella norma: GB 11250/L, Hb 12.4 g/dl, PTL 260000/L, creatinina 0.7 mg/dl, Na 138 mmol/L, K 3.5 mmol/L, PCR 3.1 mg/dl. Troponina I hs 70-404-412 ng/L.
Come approfondimento diagnostico vengono eseguite TC encefalo, negativa per lesioni, angio TC dell’aorta toraco addominale e delle arterie polmonari, che escludono rispettivamente sindrome aortica acuta ed embolia polmonare. Alla coronarografia non lesioni emodinamicamente significative.
Durante la degenza è ripetuto l’ecocardiogramma, che conferma l’aspetto mixomatoso della mitrale con prolasso di entrambi i lembi e insufficienza moderata. Si evidenzia inoltre la disgiunzione dell’annulus mitralico, entità associata a maggior rischio aritmico e di morte cardiaca improvvisa. Al TDI, si osserva un’aumentata velocità dell’onda S’ laterale sinistra (maggiore di 16 cm/s, cosiddetto Pickelhaube sign per la somiglianza con l’elmetto dei soldati prussiani), parametro che, come osservato da Muthukumar et al [1], correla con un aumentato rischio di aritmie nei pazienti con prolasso.
A completamento, è effettuata la RM cardiaca con conferma della disgiunzione mitro-anulare, curling della parete postero-laterale basale sinistra e accumulo circoscritto di LGE a livello del muscolo papillare posteriore. Gli aspetti ecocardiografici e di RM cardiaca sono riassunti nella figura 2.
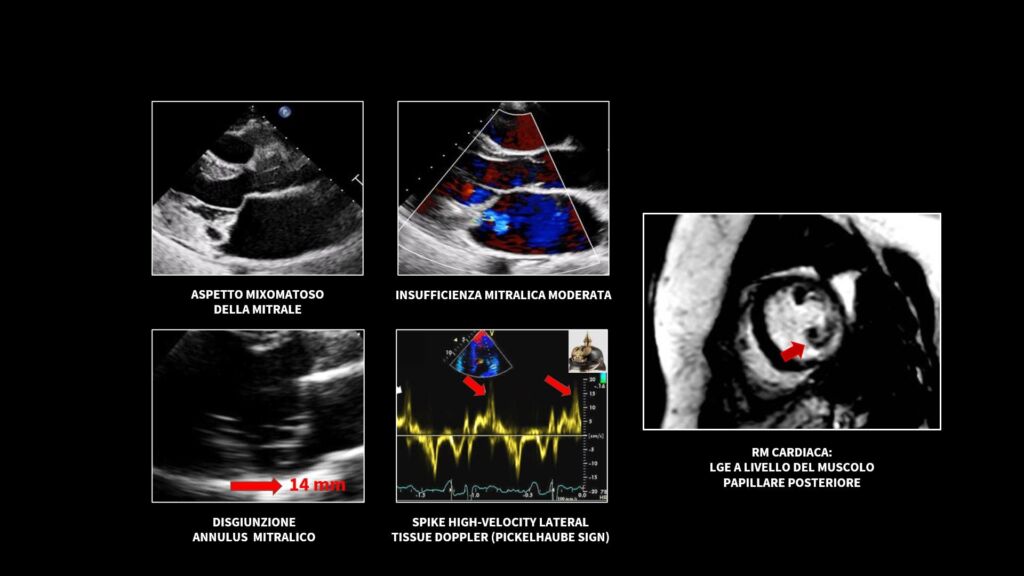
Figura 2: Ecocardiogramma e RM cardiaca del caso clinico.
Pertanto, alla luce degli esami eseguiti, l’aritmia è attribuita al prolasso mitralico con disgiunzione mitro-anulare. Abbiamo sottoposto la paziente a impianto di ICD sottocutaneo e inviata analisi genetica per pannello aritmico (in corso), comprensiva del gene della filamina A, proteina mutata in particolari fenotipi aritmici [2]. Lo screening dei familiari di primo grado è risultato negativo e la paziente è tuttora in follow-up presso il nostro Centro.
Nella popolazione, il prolasso mitralico è una condizione relativamente frequente con una prevalenza di circa 2-3%, generalmente correlato a buona prognosi in assenza di significativo rigurgito mitralico [3; 4]. Può associarsi alla disgiunzione mitro-anulare, variante anatomica dell’anello caratterizzata da un’inserzione del lembo posteriore al di sopra della giunzione mitralica. Questa entità anatomica determina, in alcuni contesti, un aumentato rischio aritmico e di morte cardiaca improvvisa, indipendentemente dalla coesistenza del prolasso [5].
L’identificazione della disgiunzione, con o senza prolasso, richiede un’attenta caratterizzazione anatomica e una stratificazione del rischio aritmico. Tale entità può infatti concorrere, insieme ad altre red flag (sesso femminile, storia di cardiopalmo o sincope, aspetto mixomatoso dei lembi mitralici, curling, aritmie ventricolari, onde T negative nelle derivazioni inferiori al tracciato ECG e LGE alla RM cardiaca) a identificare un aumentato profilo di rischio, come nel caso clinico presentato.
L’ipotesi fisiopatologica può essere riconducibile in prima istanza alla presenza della disgiunzione e del prolasso, che inducono stretch a livello del muscolo papillare posteriore e della parete postero-laterale basale del ventricolo sinistro, predisponendo allo sviluppo di fibrosi miocardica e aritmie [6; 7].
In merito alle strategie terapeutiche, pochi dati sono disponibili. L’utilizzo dei beta bloccanti correla con una riduzione del burden aritmico, tuttavia mancano trial clinici a riguardo. L’ablazione transcatetere potrebbe essere riservata a soggetti con aritmie sintomatiche e recidivanti nonostante la terapia medica, ma la procedura può essere tecnicamente difficoltosa in relazione alla sede del focus da ablare, come nel caso del muscolo papillare, o talvolta inefficace per la coesistenza di più foci [8; 9]. La correzione chirurgica è dettata dal grado della valvulopatia, mentre l’impianto del defibrillatore trova indicazione in prevenzione secondaria [10]. Ulteriori studi saranno necessari per definire il ruolo della disgiunzione mitro-anulare e le ripercussioni nella pratica clinica.
Bibliografia
1. Muthukumar L, Rahman F, Jan MF, et al. The Pickelhaube Sign: Novel Echocardiographic Risk Marker for Malignant Mitral Valve Prolapse Syndrome. JACC Cardiovasc Imaging. 2017;10(9):1078-1080.
2. Le Tourneau T, Le Scouarnec S, Cueff C, et al. New insights into mitral valve dystrophy: A Filamin-A genotype-phenotype and outcome study. Eur Heart J. 2018;39(15):1269-1277.
3. Freed LA, Levy D, Levine RA, et al. Prevalence and Clinical Outcome of Mitral-Valve Prolapse. N Engl J Med. 1999;341(1):1-7.
4. Devereux RB, Jones EC, Roman MJ, et al. Prevalence and correlates of mitral valve prolapse in a population-based sample of American Indians: The strong heart study. Am J Med. 2001;111(9):679 685.
5. Dejgaard LA, Skjølsvik ET, Lie ØH, et al. The Mitral Annulus Disjunction Arrhythmic Syndrome. J Am Coll Cardiol. 2018;72(14):1600-1609.
6. Basso C, Iliceto S, Thiene G, Perazzolo Marra M. Mitral Valve Prolapse, Ventricular Arrhythmias, and Sudden Death. Circulation. 2019;140(11):952-964.
7. Basso C, Perazzolo Marra M, Rizzo S, et al. Arrhythmic Mitral Valve Prolapse and Sudden Cardiac Death. Circulation. 2015;132(7):556-566.
8. Syed FF, Ackerman MJ, McLeod CJ, et al. Sites of Successful Ventricular Fibrillation Ablation in Bileaflet Mitral Valve Prolapse Syndrome. Circ Arrhythmia Electrophysiol. 2016;9(5).
9. Santoro F, Biase L Di, Hranitzky P, et al. Ventricular fibrillation triggered by PVCs from papillary muscles: Clinical features and ablation. J Cardiovasc Electrophysiol. 2014;25(11):1158-1164.
10. Priori SG, Blomstrom-Lundqvist C, Mazzanti A, et al. 2015 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death the Task Force for the Management of Patients with Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death of the European Society of Cardiology (ESC) Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC). Eur Heart J. 2015;36(41):2793-2867l.