INTRODUZIONE
La terapia di resincronizzazione cardiaca (Cardiac Resynchronization Therapy – CRT) rappresenta un caposaldo del trattamento dell’insufficienza cardiaca in pazienti sintomatici con blocco di branca sinistra1. L’impianto di CRT, tuttavia, è gravato da alte dosi di radiazioni ionizzanti sia per il paziente che per gli operatori, con conseguente rischio di danni sia di tipo stocastico che deterministico2-3. La necessità di ricorrere sovente ad iniezione di mezzo di contrasto iodato per la visualizzazione del seno coronarico (CS) e dei suoi rami, inoltre, si associa a nefrotossicità, in particolare in pazienti con funzione renale già compromessa, e a reazioni allergiche4-5.
Lo sviluppo di sistemi di mappaggio elettroanatomico (ElectroAnatomical Mapping System, EAMS) ha reso possibile la ricostruzione dell’anatomia delle camere cardiache e la creazione di mappe di voltaggio e/o di attivazione elettrica cardiaca senza l’utilizzo di radiazioni, registrando i potenziali d’azione intracardiaci. Questi sistemi di mappaggio sono ampiamente utilizzati per l’analisi dei meccanismi patogenetici alla base delle aritmie e per le procedure di ablazione transcatetere, dove hanno permesso di ridurre enormemente la necessità di fluoroscopia6.
Negli ultimi anni, inoltre, l’utilizzo di sistemi EAMS è stato proposto anche per l’impianto di device CRT, in modo da ridurre il tempo di fluoroscopia e l’utilizzo di mezzo di contrasto. La possibilità di avere una mappa di attivazione elettrica del CS, inoltre, può guidare il posizionamento dell’elettrocatetere ventricolare sinistro, permettendo di identificare la zona miocardica ad attivazione più tardiva7-11.
L’esecuzione di procedure di ablazione transcatetere con mappaggio elettroanatomico associate a contestuale impianto di device CRT permette di ottenere in un’unica procedura l’abolizione del substrato aritmico e l’elettrostimolazione definitiva con resincronizzazione cardiaca, il tutto ottenuto a raggi zero.
CASO 1
Uomo di 78 anni con plurimi fattori di rischio cardiovascolare, insufficienza renale cronica (IRC) ed affetto da cardiopatia ischemica esordita con infarto miocardico acuto trattato con triplice bypass aorto-coronarico e progressivamente evoluta in cardiomiopatia dilatativa ipocinetica con severa riduzione della frazione di eiezione (EF 22%) e blocco di branca sinistra (QRS 150 msec). Il paziente veniva ricoverato per scompenso cardiaco congestizio a ridotta frazione di eiezione associato a flutter atriale tipico comune ad elevata penetranza ventricolare, di nuovo riscontro. Alla luce dell’assenza di nuove lesioni coronariche con documentata pervietà dei pregressi bypass allo studio coronarografico e considerata la nota disfunzione ventricolare, veniva posta indicazione ad impianto di CRT-D “near-zero fluoroscopy” EAMS-guidato e a contestuale ablazione dell’istmo cavo-tricuspidalico.
Per il mappaggio elettroanatomico è stato utilizzato il sistema EnSite NavX, un dispositivo di navigazione intracardiaca composto da tre coppie di elettrodi adesivi posizionati a livello cutaneo su assi ortogonali in modo da generare un campo tridimensionale. Il sistema è in grado di misurare il voltaggio e l’impedenza di ogni elettrodo inserito nel campo di navigazione, localizzarne la posizione e costruire la geometria delle camere cardiache, delineandone il contorno endocardico.
Mediante accesso venoso femorale bilaterale sono stati inseriti un catetere quadripolare deflettabile fino al seno coronarico (CS) e un catetere Halo a 20 poli nell’atrio destro con i quali è stata eseguita la mappa elettroanatomica delle sezioni destre e confermata l’origine istmo-dipendente del flutter atriale. Mediante catetere RF 8 mm e stata eseguita ablazione a livello dell’istmo cavo-tricuspidalico con interruzione dell’aritmia e ripristino di un ritmo sinusale stabile, con successiva conferma di blocco del circuito tramite stimolazione dal CS (figura 1A).
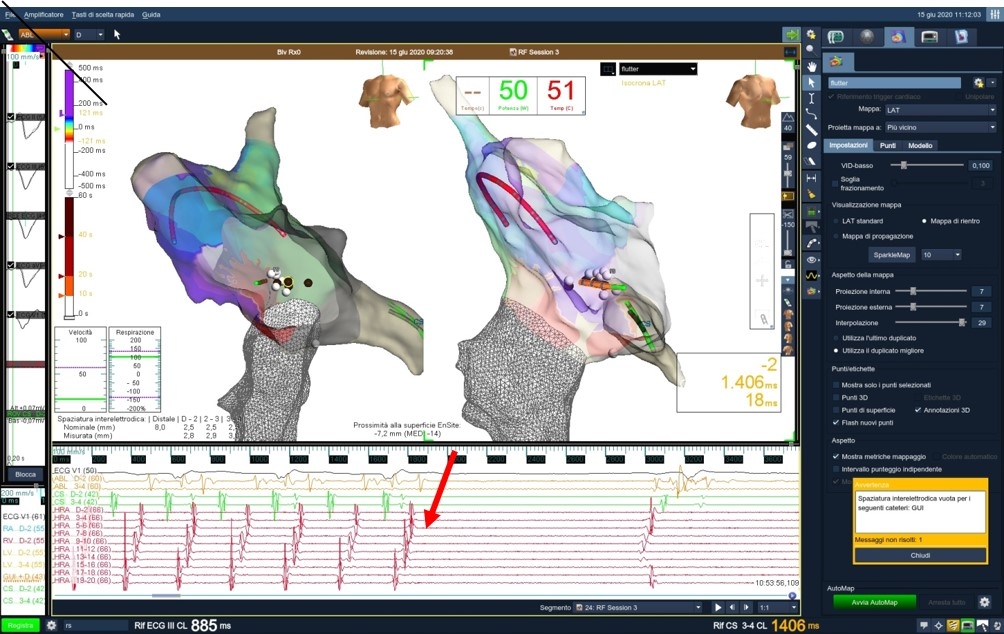
Figura 1A: evidenza di interruzione flutter atriale tipico comune (A) e successivo impianto (B) di elettrocateri in atrio destro, ventricolo destro ed in seno coronarico (con mappa di attivazione esclusivamente con guida elettroanatomica.
Nella parte alta della figura è rappresentata la mappa di attivazione elettrica dell’atrio destro, in proiezione obliqua anteriore sinistra (OAS – a sinistra) ed in proiezione obliqua anteriore destra (OAD – a destra). La mappa di colori rappresenta la sequenza di attivazione elettrica atriale, ossia in bianco la più precoce ed in viola la più tardiva. Sono visibili: il catetere in seno coronarico (CS), il catetere a venti poli (Halo) in atrio destro ed il catetere ablatore nei pressi dell’istmo cavo-tricuspidalico (IS). I punti bianchi corrispondono ai punti in cui è stata eseguita l’ablazione.
Nella parte inferiore della figura si evidenzia a livello elettrografico la presenza del circuito di attivazione elettrica “counter-clockwise” caratteristico del flutter tipico comune, con successiva interruzione e comparsa di attivazione atriale sequenziale (ritmo sinusale) dopo ablazione dell’istmo cavo-tricuspidalico (freccia).
Un EC ventricolare destro con coil è stato quindi posizionato per via cefalica sinistra a livello del setto interventricolare medio, sotto guida elettroanatomica. Sempre tramite guida con EAMS è stato inoltre posizionato un EC atriale a vite in auricola destra. A questo punto, dopo cannulazione del CS con catetere quadripolare ed introduttore dedicato per CRT, mediante una guida angiografica collegata al sistema di mappaggio sono state ricostruite l’anatomia e la mappa di attivazione del seno coronarico e dei suoi rami. È stato quindi posizionato un EC quadripolare nel ramo posterolaterale del CS, ove l’attivazione risultava più tardiva. Ogni EC è stato posizionato con parametri di sensing, impedenza e soglia di stimolazione ottimali (figura 1B). Il tempo totale della procedura è stato di 93 minuti.
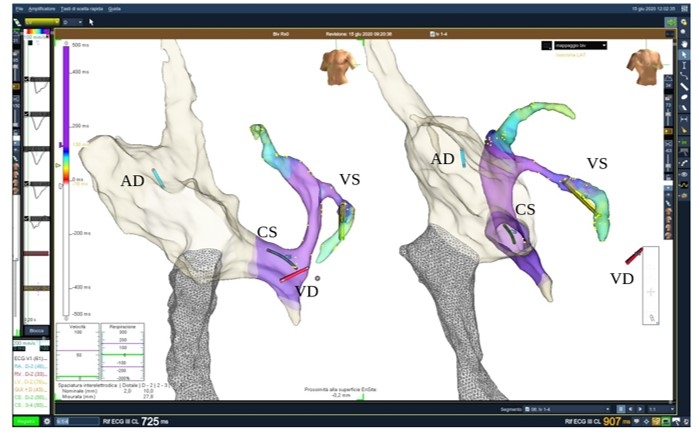
Figura 1B: a sinistra, in proiezione OAS ed a destra, in proiezione OAD, si evidenzia la mappa di attivazione elettrica del seno coronarico (CS) e dei suoi rami, in particolare il ramo posterolaterale, in cui è stato impiantato l’elettrocatetere ventricolare sinistro (VS); sono visibili anche l’elettrocatetere impiantato nell’atrio destro (AD) e nel ventricolo destro (VD).
All’elettrocardiogramma successivo alla procedura si evidenziava ritmo sinusale a 70 bpm, con stimolazione biventricolare e QRS di 100 msec.
CASO 2
Donna di 78 anni con plurimi fattori di rischio cardiovascolare, IRC (stadio IIIb) e BPCO. In anamnesi pregressi ricoveri per edema polmonare acuto in quadro di nota cardiomiopatia ipocinetica a coronarie indenni. Circa 6 mesi prima nuovo episodio di scompenso cardiaco in corso di fibrillazione atriale di nuovo riscontro non regredita né con cardioversione farmacologica né elettrica e scarsamente responsiva a terapia cronotropa negativa con metoprololo, amiodarone, verapamil o digitale. Dopo pochi mesi nuovo ricovero per recidiva di scompenso cardiaco (FE 25%) con FA ad elevata fvm, per cui, alla luce della scarsa risposta alla terapia medica e della severa disfunzione ventricolare sinistra, veniva posta indicazione ad ablazione del nodo atrioventricolare e a contestuale impianto di ICD CRT (“ablate and pace”).
Mediante accesso venoso femorale destro e sinistro, in anestesia locale, è stata eseguita la ricostruzione dell’anatomia delle camere cardiache mediante EAMS (Ensite NavX™ system St. Jude Medical, Inc., St. Paul, MN, USA) con un catetere quadripolare deflettibile poi posizionato nel CS. Un elettrocatetere singolo coil a vite è stato posizionato nell’apice ventricolare destro senza l’utilizzo di fluoroscopia bensì esclusivamente con guida elettroanatomica. Successivamente il CS è stato incannulato con una guida VisionWire con la quale è stato eseguito il mappaggio dei rami e dei ritardi di attivazione del CS. È stato quindi scelto un ramo posterolaterale (unico ramo con calibro sufficiente e con ritardo di attivazione accettabile) ed al suo interno è stato posizionato un catetere quadripolare (figura 2A).

Figura 2A: a sinistra, in proiezione OAS ed a destra, in proiezione OAD, si evidenzia la mappa di attivazione elettrica del seno coronarico (CS) con all’interno l’elettrocatetere ventricolare sinistro (VS), il fascio di His (pallino giallo) e l’elettrocatetere ventricolare destro (VD).
Per il posizionamento di tutti gli elettrocateteri sono stati testati i parametri di sensing, soglia di stimolazione ed impedenza in modo da ottenere siti di impianto ottimali.
Mediante un elettrocatetere ablatore a RF 4 mm e con guida mediante EAMS è stata quindi eseguita ablazione del NAV con evidenza di ritmo giunzionale irritativo e successivo blocco atrioventricolare totale stabile (figura 2B). Il tempo totale della procedura è stato di 130 minuti.
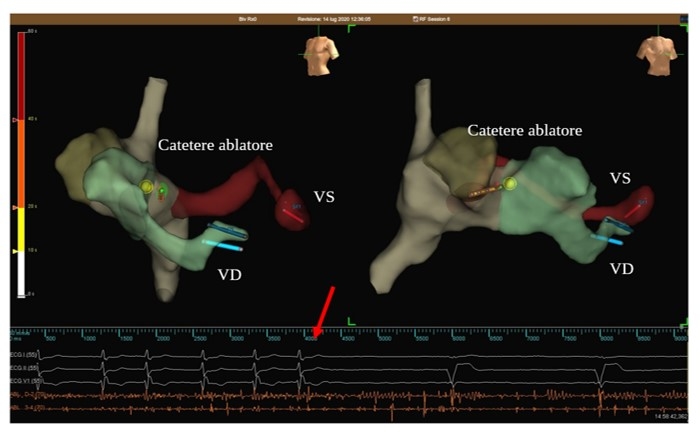
Nella parte inferiore della figura si evidenzia a livello elettrografico la comparsa di blocco atrioventricolare completo con stimolazione ventricolare da pacemaker (freccia).
DISCUSSIONE
L’utilizzo della fluoroscopia nell’impianto di device intracardiaci ed in molte procedure di ablazione transcatetere (es. crioablazione di FA) rappresenta attualmente lo standard procedurale. La comparsa, negli ultimi anni, dei sistemi di mappaggio elettroanatomico ha permesso di ridurre fino ad azzerare l’esposizione a radiazioni ionizzanti del paziente e degli operatori nella maggioranza delle procedure di ablazione transcatetere.
Alcune casistiche, inoltre, hanno proposto l’utilizzo di EAMS durante l’impianto di dispositivi CRT per potersi avvalere delle mappe di attivazione elettrica dei rami del CS con la possibilità quindi di individuare la zona a maggior ritardo elettrico, verosimile migliore sede di stimolazione ventricolare sinistra 12-14. Come evidenziato da Liang Y et al15 l’utilizzo di sistemi di mappaggio elettroanatomico per individuare tra i rami del CS la zona a maggiore ritardo di attivazione per l’impianto dell’elettrocatetere ventricolare sinistro si associa ad un maggiore tasso di responder a distanza a CRT. Rispetto ai controlli, infatti, i pazienti in cui era stato eseguito l’impianto di CRT EAMS-guidato presentavano una maggiore riduzione del volume telesistolico (>15%), un più frequente miglioramento della classe funzionale NYHA e una minore durata del QRS al tracciato elettrocardiografico.
Uno studio multicentrico di Del Greco et al16 ha valutato l’outcome dell’impianto di CRT guidato da EAMS, rispetto all’impianto tradizionale con l’utilizzo di fluoroscopia e angiografia, evidenziando un tasso di successo della procedura sovrapponibile tra casi e controlli, con il vantaggio, nel primo caso, di una minor esposizione a radiazioni ionizzanti. In particolare sia in centri di grande esperienza (> 10 impianti di CRT EAMS-guidati) che in centri minori, la procedura è risultata sicura ed efficace, permettendo di ridurre l’uso della fluoroscopia del 75% e dell’angiografia del 70%.
Se è vero che l’acquisizione della mappa dell’anatomia del CS con sistemi di mappaggio elettroanatomico consente la selezione di un ramo target potenzialmente più idoneo a ottenere una ottimale risposta clinica (scelta del ramo con maggiore ritardo di attivazione), è anche vero che essa è limitata dalla capacità di penetrazione della guida impiegata per il mappaggio e dall’assenza di una documentazione angiografica dei rami tributari del CS. Per migliorare la scelta del ramo target, tuttavia, potrebbe anche essere effettuata prima della procedura una acquisizione RMN del cuore (quindi, anche in questo caso, con assente esposizione a radiazioni ionizzanti), fondendo le immagini ottenute con il mappaggio elettroanatomico e navigando di conseguenza un accurato modello tridimensionale. Nei casi presentati non abbiamo utilizzato tale metodica, ritenendo soddisfacente quanto ottenuto con il solo mappaggio elettroanatomico.
Un limite dell’esecuzione di ablazione ed impianto di CRT a raggi zero potrebbe essere rappresentato da un allungamento dei tempi procedurali. Nel nostro centro, tuttavia, il tempo totale della procedura non è risultato significativamente aumentato: la procedura è piuttosto semplice per un operatore abituato all’impiego dei sistemi di mappaggio in elettrofisiologia e rende più rapida e precisa la procedura di ablazione.
I maggiori costi dell’impiego del mappaggio elettroanatomico rispetto all’impianto standard rappresentano un altro limite di queste procedure combinate a raggi zero. La differenza di costo potrebbe essere ridotta con alcuni accorgimenti ed ottimizzazione dei materiali; ad esempio, evitando l’impiego di cateteri mappanti aggiuntivi (catetere hisiano, catetere multipolare in atrio destro, ecc), facendo affidamento sui soli segnali registrati con il catetere ablatore e sulle mappe di attivazione/anatomia ottenute con il sistema.
CONCLUSIONI
L’esecuzione di procedure di ablazione TC con sistemi di mappaggio associata a contestuale impianto di CRT guidato dalla mappa elettroanatomica sia delle camere cardiache, sia delle ramificazioni del CS, permette di ottenere in una singola procedura la risoluzione del substrato aritmico e l’impianto del dispositivo di resincronizzazione cardiaca, ottimizzato in base alle caratteristiche elettriche del singolo paziente e senza l’utilizzo di fluoroscopia. La riduzione dell’esposizione a radiazioni ionizzanti associata alla possibilità di individuare nel singolo paziente la migliore sede di stimolazione ventricolare sinistra, assicurando così un maggiore beneficio della CRT, rappresentano allettanti motivazioni per implementare queste tecniche nella comune pratica interventistica.
RINGRAZIAMENTI
Un grazie speciale al dott. Gabriele Dell’Era ed alla dott.ssa Crizia Colombo per il loro fondamentale aiuto nella stesura di questi casi clinici. Ringrazio inoltre la dott.ssa Laura Gatto ed il Prof. Francesco Prati per l’opportunità gentilmente offertami.
BIBLIOGRAFIA
- Brignole M, Auricchio A, Baron-Esquivias G, et al. 2013 ESC guidelines on cardiac pacing and cardiac resynchronization therapy: The task force on cardiac pacing and resynchronization therapy of the European Society of Cardiology (ESC). Developed in collaboration with the European Heart Rhythm Association (EHRA). Europace 2013;15:1070-1118.
- Butter C, Schau T,Meyhoefer J, Neumann K, et al. Radiation exposure of patient and physician during implantation and upgrade of cardiac resynchronization devices. Pacing Clin Electrophysiol 2010;33:1003-1012.
- Picano E, Vano E, Rehani MM, et al. The appropriate and justified use of medical radiation in cardiovascular imaging: A position document of the esc associations of cardiovascular imaging, percutaneous cardiovascular interventions and electrophysiology. Eur Heart J 2014;35:665-672.
- Cowburn PJ, Patel H, Pipes RR, et al. Contrast nephropathy post cardiac resynchronization therapy: An under-recognized complication with important morbidity. Eur J Heart Fail 2005;7:899-903.
- Kowalczyk J, Lenarczyk R, Kowalski O, et al. Contrast-induced acute kidney injury in patients undergoing cardiac resynchronization therapy-incidence and prognostic importance. Sub-analysis of data from randomized trust crt trial. J Interv Card Electrophysiol 2014;40:1-8.
- Giaccardi M, Del Rosso A, Guarnaccia V, et al. Near-zero x-ray in arrhythmia ablation using a 3-dimensional electroanatomic mapping system: A multicenter experience. Heart Rhythm 2016;13:150-156.
- Singh JP, Fan D, Heist EK, et al. Left ventricular lead electrical delay predicts response to cardiac resynchronization therapy. Heart Rhythm 2006;3:1285-1292.
- Ypenburg C, van Bommel RJ, Delgado V, et al. Optimal left ventricular lead position predicts reverse remodeling and survival after cardiac resynchronization therapy. J Am Coll Cardiol 2008;52:1402-1409.
- Gold MR, Birgersdotter-Green U, Singh JP, et al. The relationship between ventricular electrical delay and left ventricular remodelling with cardiac resynchronization therapy. Eur Heart J 2011;32:2516-2524.
- Khan FZ, Virdee MS, Palmer CR, et al. Targeted left ventricular lead placement to guide cardiac resynchronization therapy: The target study: A randomized, controlled trial. J Am Coll Cardiol 2012;59:1509-1518.
- Kydd AC, Khan FZ, Watson WD, et al. Prognostic benefit of optimum left ventricular lead position in cardiac resynchronization therapy: Follow-up of the target study cohort (targeted left ventricular lead placement to guide cardiac resynchronization therapy). JACC Heart Fail 2014;2:205-212.
- Ryu K, D’Avila A, Heist EK, et al. Simultaneous electrical and mechanical mapping using 3D cardiac mapping system: Novel approach for optimal cardiac resynchronization therapy. J Cardiovasc Electrophysiol 2010;21:219-222.
- Mafi Rad M, Blaauw Y, Dinh T, et al. Different regions of latest electrical activation during left bundle-branch block and right ventricular pacing in cardiac resynchronization therapy patients determined by coronary venous electroanatomic mapping. Eur J Heart Fail 2014;16:1214-1222.
- Niazi I, Ryu K, Hood R, et al. Three-dimensional electroanatomic mapping of the coronary veins during cardiac resynchronization therapy implant: Feasibility and possible applications. J Interv Card Electrophysiol 2014;41:147-153.
- Liang Y, Yu H, Zhou W, et al. Left ventricular lead placement targeted at the latest activated site guided by electrophysiological mapping in coronary sinus branches improves response to cardiac resynchronization therapy. J Cardiovasc Electrophysiol 2015;26:1333-1339.
- Del Greco M, Maines M, Marini M, et al. Three-Dimensional Electroanatomic Mapping System-Enhanced Cardiac Resynchronization Therapy Device Implantation: Results From a Multicenter Registry. J Cardiovasc Electrophysiol 2015; 28(1): 85–93.