Nell’agosto del 2021 un uomo di 43 anni, forte tabagista (40 sigarette/die) ed affetto da obesità di I grado (BMI 34.9 kg/mq), con familiarità per patologie cardiovascolari, si è recato in Pronto Soccorso (PS) per recidiva di angor persistente, già sperimentato il giorno precedente con successiva risoluzione spontanea.
All’arrivo in PS è stata fatta diagnosi di infarto miocardico con sopraelevazione del tratto ST (STEMI) in sede antero-laterale, per cui il paziente è stato sottoposto a coronarografia con riscontro di occlusione di arteria interventricolare anteriore (IVA) prossimale. È stata eseguita una procedura di angioplastica coronarica (PTCA) con impianto di stent medicato su IVA, ed una procedura mediante palloncino (POBA) a carico di un ramo settale.
All’ecocardiogramma transtoracico (ETT) evidenza di ventricolo sinistro (VS) di normali dimensioni, con acinesia apicale e FE 45%. Riscontro incidentale di una formazione tondeggiante di 33 x 24 mm in atrio sinistro, con peduncolo e base d’impianto di 10 mm sul setto interatriale (SIA) in prossimità del piano valvolare mitralico, mobile, con impegno della mitrale durante il ciclo cardiaco, non precedentemente nota.
Per tale motivo il giorno successivo il paziente è stato trasferito presso il reparto di Cardiochirurgia dell’Ospedale S. Raffaele di Milano per la prosecuzione delle cure. Agli esami ematochimici evidenza di GB 14.9 x 10^9/L, Hb 14.3 g/dL, Ht 43.2%, PLT 239 x 10^9/L; Bilirubina tot 1.32 mg/dL, Bilirubina dir 0.45 mg/dL, Bilirubina indir 0.87 mg/dL; AST 398 U/L, ALT 70 U/L; CPK 2613 U/L, Troponina T 4198 ng/L; funzionalità renale, elettroliti e coagulazione nella norma.
Alla Radiografia del torace risocntro di strie distelectasiche al campo inferiore sinistro; cuore di dimensioni aumentate ed Ili accentuati di aspetto vascolare.
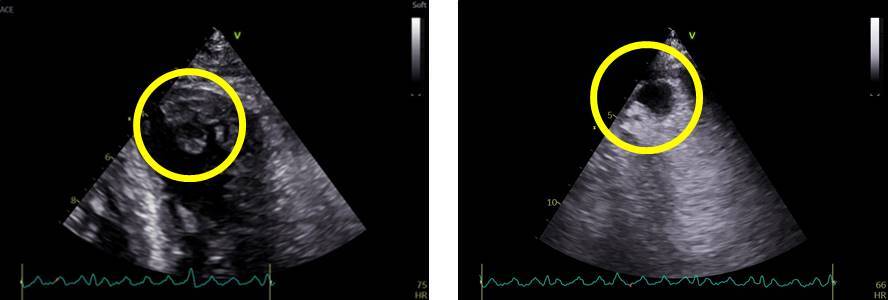
E’ stato ripetuto un ecocardiogramma transtoracico (FIG. 1) che ha mostrato à ventricolo sinistro: DTD 58 mm, VTD 173 ml (indicizzato 86 ml/mq), SIV 12 mm; FE 35%,acinesia/scar dell’apice in toto e dei segmenti medi della parete anteriore/SIV anteriore, ipocinesia del segmento medio delle pareti posteriore e laterale; formazione di 20 x 19 mm ad ecogenicità miocardica a livello apicale compatibile con trombosi endocavitaria. In Atrio sinistro evidenza di una Massa peduncolata di 55 x 28 mm, molto mobile, capsulata con nucleo colliquato, con base di impianto a livello del SIA anteriore a circa 8 mm dal piano mitralico; impegno dell’orifizio valvolare mitralico con ostruzione di grado lieve in diastole (area planimetrica residua 1.5-2 cmq, gradiente medio transmitralico 4 mmHg); lieve IM associata.

Il paziente è stato discusso in Heart Team, e sono state prese in considerazione le seguenti opzioni diagnostico-terapeutiche:
- Esclusivo monitoraggio clinico post-STEMI e successiva dimissione;
- Monitoraggio clinico post-STEMI, approfondimento diagnostico (TC torace-addome con mdc, RM cardiaca, emocolture, ECD venoso arti inferiori), eventuale terapia medica e successiva dimissione;
- Intervento cardiochirurgico in urgenza;
- Monitoraggio clinico post-STEMI, approfondimento diagnostico (TC torace-addome con mdc, RM cardiaca, emocolture, ECD venoso arti inferiori), eventuale terapia medica, dimissione e riprogrammazione di intervento cardiochirurgico in elezione.
Alla luce delle significative dimensioni della massa atriale sinistra e del suo grado di mobilità, con rischio di embolizzazione ed ostruzione del tratto di efflusso ventricolare sinistro, si è deciso di eseguire un intervento cardiochirurgico in regime d’urgenza. In circolazione extracorporea, sono state effettuate un’atriotomia destra ed un’incisione del SIA attraverso la fossa ovale, e la neoformazione atriale sinistra è stata asportata in toto con il relativo peduncolo d’impianto.
Così come il cavallo di Troia celava al proprio interno un’insidia, rappresentata dai guerrieri greci, allo stesso modo l’esame istologico estemporaneo ha rivelato la presenza di una componente linfomatosa all’interno della massa stessa.
Il decorso postoperatorio in Terapia Intensiva Cardiochirurgica è stato caratterizzato da:
- Necessità di supporto inotropo (adrenalina a medio dosaggio) e meccanico (contropulsatore aortico, rimosso in quinta giornata postoperatoria) per severa disfunzione ventricolare sinistra;
- Insorgenza di fibrillo-flutter atriale con plurimi tentativi infruttuosi di cardioversione elettrica, per cui sono stati impostati controllo della frequenza cardiaca mediante amiodarone ev e terapia anticoagulante;
- Cicli di ventilazione meccanica non invasiva post-estubazione.
Il decorso postoperatorio in Reparto di Cardiochirurgia è stato caratterizzato da:
- Stabilizzazione del quadro clinico, in assenza di complicanze;
- Esecuzione di una visita oncoematologica, che ha consigliato approfondimento diagnostico mediante TC torace-addome cmc e PET total body. In tal modo sono state escluse ulteriori localizzazioni di malattia linfomatosa o secondarismi;
- Esecuzione di ETT seriati per il monitoraggio della formazione trombotica apicale sinistra, con quadro di stabilità della medesima (FIG. 2).
In data 26/08/2021 il paziente è stato dimesso dal Reparto di Cardiochirurgia ai fini di eseguire la prevista riabilitazione cardiologica postoperatoria. Alla dimissione gli esami ematochimici risultavano compatibili con lo status postoperatorio.
All’esame istologico definitivo, pervenuto in seguito alla dimissione del paziente, la massa atriale sinistra si è rivelata un mixoma atriale, contenente un linfoma diffuso a grandi cellule B – sottotipo associato a fibrina (FIG. 3).

Nel mese di settembre 2021 il paziente è stato sottoposto a visita oncoematologica, per cui non è stata impostata alcuna terapia specifica, ma è stata posta indicazione ad esclusivo follow-up clinico-strumentale.
Nel mese di ottobre 2021 il paziente ha eseguito un ECG Holter/24 h, con evidenza di ripristino di ritmo sinusale. All’ETT di controllo risoluzione della trombosi apicale a livello del VS, con parziale recupero della funzione ventricolare sinistra rispetto al preoperatorio (FEVS 48-50%, con acinesia dell’apice in toto e del segmento medio della parete anteriore).
Nel mese di febbraio 2022 il paziente è sottoposto a biopsia osteo-midollare, risultata negativa per localizzazione di processo linfoproliferativo.
Nei mesi di aprile e settembre 2022 il paziente ha ripetuto visite di controllo oncoematologiche, le quali hanno confermato un buon andamento clinico e hanno confermato l’indicazione all’esclusivo follow-up clinico strumentale, senza necessità di terapia specifica.
Discussione
I linfomi cardiaci rappresentano tra il 9 ed il 24% dei tumori cardiaci, e si dividono in primitivi (nell’80% dei casi linfomi non-Hodgkin diffusi a cellule B) e secondari.
Il primo caso di linfoma diffuso a grandi cellule B – sottotipo associato a fibrina- insorto all’interno di un mixoma atriale è stato riportato in letteratura nel 2009 [1].
Nello specifico, il sottotipo associato ad infiammazione cronica presenta delle peculiarità, che sono costituite dalla mancata formazione di masse e dall’assenza di sintomi diretti. La diagnosi istologica abitualmente è incidentale, e viene effettuata su di un pezzo chirurgico asportato per altra indicazione.
Il linfoma diffuso a grandi cellule B – sottotipo associato a fibrina, infatti, è stato descritto all’interno di un mixoma, di una pseudocisti, di un trombo o di un ematoma localizzati a livello di cuore e vasi (56% dei casi), addome (milza, surrene/rene, retroperitoneo e apparato riproduttivo nel 28% dei casi), sistema nervoso centrale (10% dei casi) e ginocchio (6% dei casi) [2].
Tra il 2009 ed il 2020 sono stati descritti in letteratura 16 casi di linfoma diffuso a grandi cellule B – sottotipo associato a fibrina- all’interno di un mixoma atriale, di cui il 50% erano uomini, con età media di 61 anni. Dieci pazienti (71%) sono risultati positivi al virus di Ebstein-Barr (EBV), e questo ha dato origine a diverse ipotesi patogenetiche:
- L’invecchiamento del sistema immunitario potrebbe accompagnarsi ad una ridotta risposta T-mediata, con conseguente ridotta immunosorveglianza nei confronti di EBV ed invasione dei linfociti B da parte del virus;
- L’infiammazione cronica presente all’interno del mixoma, mediata da interleuchine quali IL-6 e IL-10, promuoverebbe la riduzione dell’immunosorveglianza e predisporrebbe a tromboembolismo e ad insorgenza di sintomi, altrimenti assenti;
- L’associazione tra età avanzata, mixoma e infiammazione cronica creerebbe un microambiente favorevole alla proliferazione di linfociti EBV +, con predisposizione alla patologia.
Tra le opzioni terapeutiche riportate, figurano la chirurgia (15 pazienti- 94%) e la chemioterapia (8 pazienti – 50%), associata o meno a radioterapia. Al follow-up, 5 pazienti (31%) risultavano deceduti in un arco temporale compreso tra i 2 e gli 8 mesi postoperatori, per cause varie (sconosciute, conseguenti a chemioterapia, per infarto miocardico o ictus ischemico). Otto pazienti (50%) risultavano in vita, senza evidenza di malattia, mentre tre (19%) figuravano persi al follow-up.
In conclusione, il linfoma diffuso a grandi cellule B – sottotipo associato a fibrina sembrerebbe comportarsi come una patologia a decorso indolente, per cui l’asportazione in toto della massa all’interno della quale si sviluppa parrebbe associarsi ad una prognosi favorevole, anche in assenza di chemioterapia e radioterapia. Al momento attuale sono ancora troppo pochi i dati disponibili per quanto concerne il follow-up a lungo termine, in considerazione della estrema rarità della patologia. Per tale motivo, risulta indispensabile procedere con uno stretto follow-up clinico-strumentale dei pazienti.
Bibliografia
[1] Bagwan IN,.Desai S, Wotherspoon A, Sheppard MN. Unusual presentation of primary cardiac lymphoma. Interact Cardiovasc Thorac Surg. 2009 Jul; 9 (1): 127-9.
[2] Chu W, Zhang B, Zhang Y et al. Fibrin-associate diffuse large B-Cell lymphoma arising in a left atrial myxoma: a case report and literature review. Cardiovasc Pathol 2020 Nov-Dec; 49: 107264.