Nell’ottobre 2019 un uomo di 57 anni, diabetico ed iperteso, accede in Pronto Soccorso per febbricola persistente da circa 10 giorni associata a malessere generale, in assenza di segni di localizzazione. In anamnesi: cardiopatia ischemica cronica con esiti di rivascolarizzazione percutanea (nel 2012 sottoposto ad angioplastica primaria con posizionamento di stent medicato sul ramo interventricolare anteriore) e chirurgica (nel 2013 sottoposto ad intervento di bypass in arteria mammaria interna sinistra per il ramo interventricolare anteriore). Nel 2013 eseguito impianto di ICD monocamerale in prevenzione primaria; sottoposto a sostituzione del generatore in luglio 2019.
All’ingresso l’esame obiettivo è nella norma, in particolare non si rilevano segni di infiammazione a livello della tasca del generatore. Agli esami di laboratorio riscontro di lieve rialzo degli indici di flogosi (GB 12.700/mmc, PCR 4 mg/dL, PCT 1.8 pg/dL). Eseguiti esami colturali su sangue e urine e tampone nasale per l’influenza, che risultano negativi. Alla radiografia del torace non segnalate alterazioni di rilievo, si dispone pertanto il ricovero del paziente per accertamenti clinico-laboratoristici e si avvia terapia empirica con ceftriaxone.

All’ecocardiogramma transtoracico non elementi suggestivi di endocardite. Dopo due giorni di terapia persistenza di febbricola e comparsa di dolore all’emitorace destro, con riscontro alla TC torace di un addensamento parenchimale subpleurico destro compatibile con fenomeni flogistici (Figura 1). Si ripetono le emocolture e si ricercano gli antigeni urinari di legionella e pneumoccocco, che risultano negativi. Viene dunque sostituita la terapia antibiotica in corso con piperacillina/tazobactam, per ulteriori 10 giorni di terapia.
Al termine del ciclo di antibiotico recidiva di febbre con picchi fino a 38.2°C. In considerazione dell’elevato sospetto di infezione legata al dispositivo cardiaco impiantabile (CIED), data anche la recente sostituzione del generatore, si ripete ecocardiogramma transtoracico e transesofageo con riscontro di multiple vegetazioni mobili, la maggiore di 28 mm, adese all’elettrocatetere (Figura 2). Viene ripresa la terapia antibiotica con piperacillina/tazobactam in associazione con daptomicina.

Per completare l’iter diagnostico e ottimizzare il management peri-operatorio, seppur con i limiti legati alla terapia antibiotica in corso, viene eseguita PET-FDG, con riscontro di aree di lieve iperfissazione a livello di un addensamento in sede polmonare destra (SUV max 2.5) e assenza di ulteriori captazioni patologiche di radiofarmaco.
Data la presenza di endocardite CIED-relata sono indicate l’estrazione e la terapia antibiotica protratta prima del re-impianto. In considerazione delle dimensioni delle vegetazioni > 2cm il caso è stato discusso collegialmente con i Colleghi della Cardiochirurgia. Alla luce delle comorbidità e della pregressa sternotomia, la rimozione chirurgica è stata considerata ad alto rischio ed è stata eseguita estrazione percutanea previa aspirazione delle vegetazioni con sistema AngioVac (Figura 3).
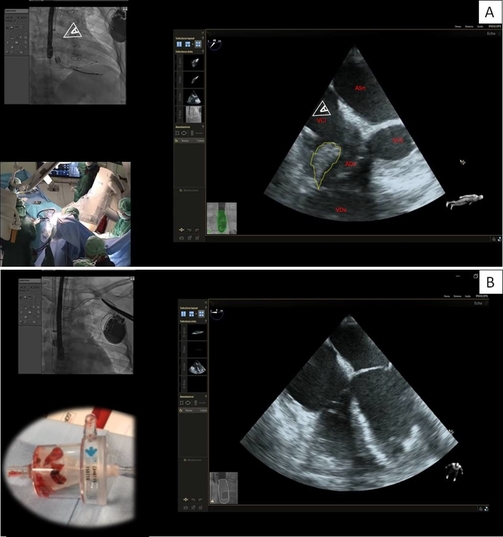
Gli esami colturali intraoperatori risultano positivi per St. Epidermidis, mentre le emocolture eseguite il giorno dell’estrazione e dopo 48 ore sono negative. A 14 giorni dall’estrazione viene eseguito reimpianto di defibrillatore sottocutaneo. La terapia antibiotica mirata con cefazolina e daptomicina è proseguita per un totale di 4 settimane post estrazione.
DISCUSSIONE:
Le infezioni sono una tra le più frequenti complicanze legate ai CIED e sono associate ad un elevato tasso di mortalità e morbilità. Seppur con i limiti legati all’assenza di una raccolta sistematica dei dati associati alle infezioni CIED-relate, registri e studi retrospettivi sembrano suggerire che, parallelamente ad un aumento del numero e della complessità degli impianti, vi sia un progressivo aumento dell’incidenza delle infezioni CIED-relate. [1,2]
Le infezioni dei CIED vengono classificate in 2 categorie: le infezioni della tasca e le infezioni sistemiche/endocarditi infettive. A queste due categorie va aggiunto un terzo gruppo che sono le infezioni della ferita, che coinvolgono la cute e il tessuto sottocutaneo, senza interessamento della tasca del generatore. Le infezioni della tasca sono caratterizzate da segni e sintomi di infiammazione locale come eritema, edema e dolore, dalla presenza di erosione e deformazione della tasca e della comparsa di materiale purulento. La diagnosi di infezione sistemica/endocardite infettiva associata a dispositivo risulta invece più complessa, in particolare quando non concomita infezione della tasca, in quanto si presenta spesso con sintomi aspecifici (febbre, astenia, sudorazione notturna). Nei pazienti portatori di CIED le infezioni si possono presentare con segni di embolizzazione a livello polmonare e pleurico, che vengono spesso misdiagnosticate come infezioni polmonari primitive, come nel caso esposto [3].
Per cercare di uniformare e rendere più agevole la diagnosi di infezioni CIED-relate nel 2019 sono stati definiti i nuovi criteri internazionali, che pongono ulteriore attenzione sull’utilizzo di tecniche di imaging come la tomografia ad emissione di positroni (PET) e l’ecografia intracardiaca[4].
La PET si è rivelata uno strumento ad elevata sensibilità e specificità nel rilevamento e la localizzazione di infezioni legate ai dispositivi, permettendo allo stesso tempo, grazie ad una valutazione di tutto il corpo, di identificare localizzazioni emboliche a livello polmonare, osseo, splenico [5]. Inoltre la PET sembra avere un ruolo anche nella stratificazione del rischio di mortalità dopo l’estrazione, fornendo potenziali informazioni per ottimizzare la gestione terapeutica [6].
L’estrazione percutanea transvenosa è la tecnica di prima scelta nell’estrazione, in quanto gravata da minori complicanze e minor mortalità rispetto alla chirurgia open. Tuttavia, l’approccio chirurgico dovrebbe essere considerato, qualora l’estrazione percutanea risulti impossibile o incompleta e quando le vegetazioni hanno dimensioni >20 mm, in quanto la procedura percutanea presenta un rischio di embolizzazione polmonare elevato. Il sistema AngioVac consiste in una cannula di aspirazione che viene inserita attraverso la vena giugulare in atrio destro e collegata ad un circuito veno-venoso extracorporeo con un filtro in linea. Il sangue aspirato viene poi reinfuso attraverso una via venosa, tipicamente posizionata nella vena femorale. Il sistema AngioVac si è rivelato un efficace strumento nell’aspirazione di vegetazioni di grandi dimensioni riducendo così il rischio di embolizzazione e dimostrandosi una valida alternativa all’opzione chirurgica [7].
In caso di infezione CIED-relata tutte le parti dell’hardware devono essere rimosse e l’indicazione al reimpianto deve essere valutata. Non esistono trial randomizzati che forniscano indicazioni precise sul timing del reimpianto, che dovrebbe essere evitato e ritardato perlomeno fino a quando non si sono risolti i segni e sintomi locali e sistemici dell’infezione.
Nei pazienti ad elevato rischio infettivo per decenni si è ricorsi all’impianto di cateteri epicardici, tuttavia negli ultimi anni lo sviluppo di cateteri leadless e di ICD sottocutanei ha offerto nuove possibilità. Nei pazienti che non necessitano di ATP o CRT, il reimpianto di un ICD sottocutaneo si è rivelato una valida alternativa in quanto gravato da un minor rischio di infezione [8,9].
Conclusione:
Il presente caso clinico evidenzia la complessità della diagnosi di infezione CIED-relata e la necessità di personalizzazione del management durante estrazione e reimpianto.
Bibliografia
- Dai M, Cai C, Vaibhav V, et al. Trends of Cardiovascular Implantable Electronic Device Infection in 3 Decades: A Population-Based Study. JACC Clin Electrophysiol. 2019;5:1071–1080.
- Diemberger I, Boriani G, editors. Infections of Cardiac Implantable Devices: A Comprehensive Guide. Springer International Publishing; 2020.
- Klug D, Lacroix D, Savoye C, et al. Systemic infection related to endocarditis on pacemaker leads: Clinical presentation and management. Circulation. 1997;95:2098–2107.
- Blomström-Lundqvist C, Traykov V, Erba PA, et al. European Heart Rhythm Association (EHRA) international consensus document on how to prevent, diagnose, and treat cardiac implantable electronic device infections – Endorsed by the Heart Rhythm Society (HRS), the Asia Pacific Heart Rhythm Society (APHRS), the Latin American Heart Rhythm Society (LAHRS), International Society for Cardiovascular Infectious Diseases (ISCVID) and the European Society of Clinical Microbiology and Infectious Diseases (ESCMID) in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS). Europace. 2020;22:515–516.
- Amraoui S, Tlili G, Sohal M, et al. Contribution of PET Imaging to the Diagnosis of Septic Embolism in Patients with Pacing Lead Endocarditis. JACC Cardiovasc Imaging. 2016;9:283–290.
- Diemberger I, Bonfiglioli R, Martignani C, et al. Contribution of PET imaging to mortality risk stratification in candidates to lead extraction for pacemaker or defibrillator infection: a prospective single center study. Eur J Nucl Med Mol Imaging. 2019;46:194–205.
- Starck CT, Eulert-Grehn J, Kukucka M, et al. Managing large lead vegetations in transvenous lead extractions using a percutaneous aspiration technique. Expert Rev Med Devices. 2018;15:757–761.
- Boersma L, Burke MC, Neuzil P, et al. Infection and mortality after implantation of a subcutaneous ICD after transvenous ICD extraction. Heart Rhythm. 2016;13:157–164.
- Viani S, Migliore F, Tola G, et al. Use and outcomes of subcutaneous implantable cardioverter-defibrillator (ICD) after transvenous ICD extraction: An analysis of current clinical practice and a comparison with transvenous ICD reimplantation. Heart Rhythm. 2019;16:564–571.