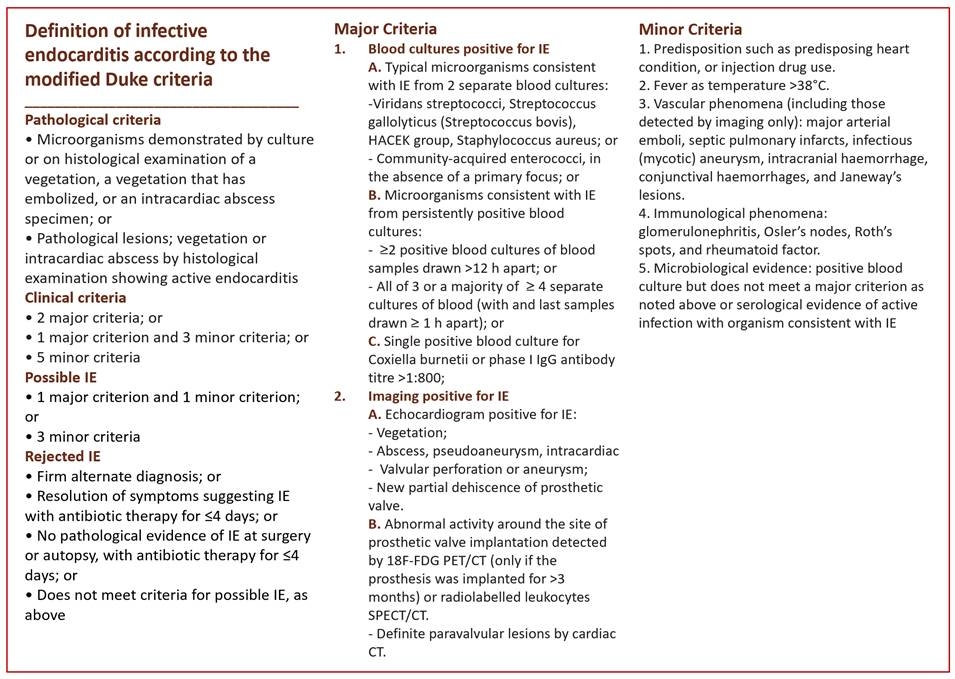
L’endocardite infettiva (EI) è una condizione rara, ma potenzialmente fatale. La diagnosi precoce di EI in pronto soccorso è auspicabile al fine di iniziare rapidamente la terapia antibiotica, di ridurre la morbilità e la mortalità intraospedaliera (15-30%). Nelle più recenti linee guida, la diagnosi di EI è basata sui criteri di Duke modificati (Fig. 1); questa classificazione ha una sensibilità di circa l’80%.
Nella pratica clinica, comunque, i criteri di Duke modificati hanno una minor accuratezza nella fase precoce della malattia, specialmente nei casi di endocarditi su protesi valvolari (EPV).
Nella serie di casi qui riportati, è enfatizzato il ruolo dell’ecocardiografia transtoracica (ETT) eseguita in pronto soccorso come uno strumento “salva-tempo” per la diagnosi precoce di EI.
Vengono descritti 5 casi di endocardite infettiva diagnosticati nel Dipartimento di Emergenza e Accettazione del Policlinico Umberto I, Sapienza Università di Roma, grazie all’uso “bedside” dell’ETT. L’età media dei pazienti era 47±21 anni e il 60% erano maschi.
Il tempo medio dall’insorgenza dei sintomi (principalmente febbre e dispnea) all’ingresso in ospedale erano 26±11giorni e nel 40% dei casi l’antibiotico-terapia è stata iniziata empiricamente dal medico curante prima dell’ospedalizzazione. In 3/5 (60%) dei soggetti, l’EI riguardava valvole native e, tra questi, 2/3 (66%) avevano anomalie valvolari strutturali (prolasso); nei rimanenti 2 soggetti (40%), l’EI riguardava una protesi valvolare.
I casi erano così distribuiti:
- EI su valvola polmonare protesica in un giovane paziente con tetralogia di Fallot operata in età pediatrica (Figura 2);
- EI su valvola tricuspide nativa in una giovane donna con malattia di Ebstein’s (Figura 3 A);
- EI su protesi valvolare aortica di tipo biologico impiantata 4 mesi prima (Figura 3 B);
- EI su valvola tricuspide nativa;
- EI su valvola mitrale prolassante. Tra questi pazienti, il 60% aveva compromissione immunologica e il 20% aveva fatto uso di droghe.
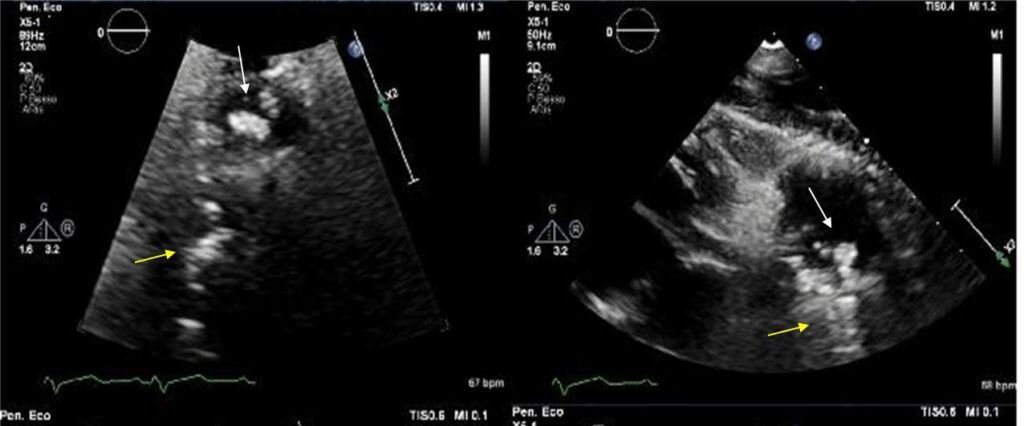
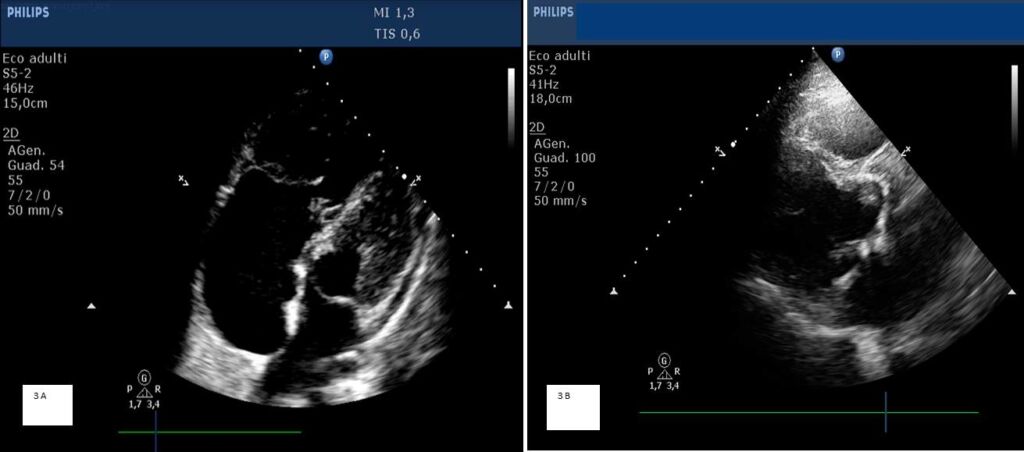
Figura 3 A: Endocardite su valvola tricuspide in paziente con malattia di Ebstein; la freccia bianca indica la vegetazione sul lembo settale della valvola tricuspide; Figura 3 B: Endocardite su protesi valvolare aortica di tipo biologico; la freccia bianca indica la vegetazione prolassante nella cavità ventricolare sinistra durante la fase sistolica del ciclo cardiaco.
In accordo con i criteri di Duke modificati, la diagnosi di EI in pronto soccorso è stata considerata “certa” nel 60% dei pazienti e “probabile” nel restante 40%.
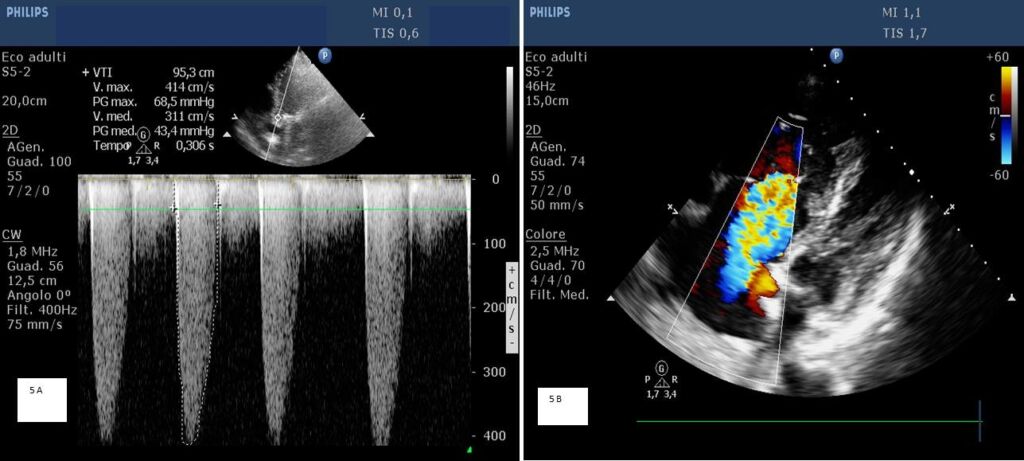
In particolare in 4/5 (80%) pazienti vi era evidenza di vegetazione all’ecocardiogramma transtoracico eseguito in pronto soccorso e, inoltre, sono state evidenziate modifiche della flussimetria valvolare come il rapido ad esempio il rapido incremento del gradiente transvalvolare (Figura 4 e Figura 5A) o variazioni del grado di insufficienza (Figura 5B); spesso il coinvolgimento valvolare è dimostrabile con proiezioni ecocardiografiche non convenzionali (fuori asse e/o multiplane).

Nel 40% dei pazienti vi era una complicanza valvolare (ascesso e perforazione di lembi), specialmente nel caso di endocardite su protesi valvolari. Nel 60% dei pazienti vi erano segni di embolizzazione distale (Figura 6).
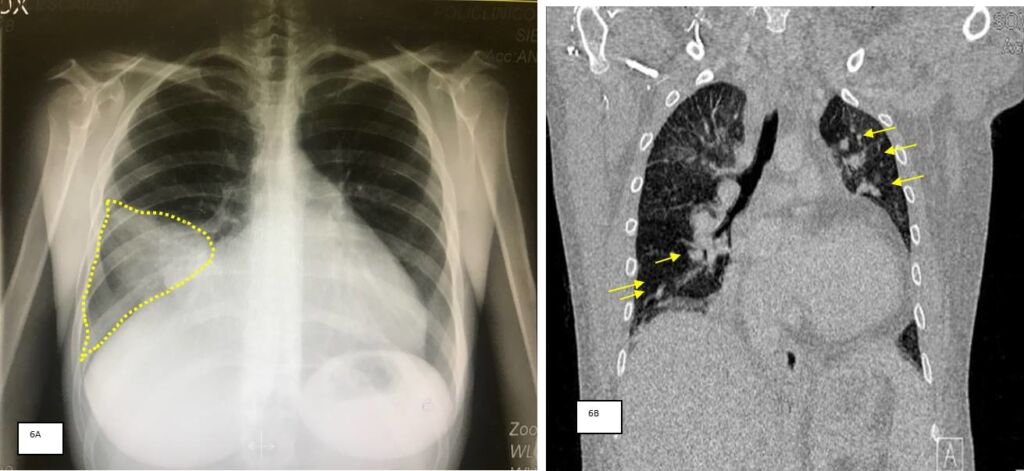
Globalmente, il tempo medio di diagnosi era 20±17 ore, quando, però, l’ETT era parte della rapida valutazione diagnostica mirata alla ricerca di EI, il tempo di diagnosi si riduceva (7±6 ore vs 34±19 con un Δore di 26, p=0.2). La terapia antibiotica specifica (TA) veniva iniziata entro circa 2 ore dalla diagnosi di EI. La durata media della terapia era 40±12 giorni ed il 40% dei pazienti è stato sottoposto ad intervento cardiochirurgico.
Al follow up a 6 mesi, il tasso di sopravvivenza era del 100% e tutti pazienti risultavano guariti dall’EI.
La diagnosi di EI è una vera sfida per tutti i cardiologi che lavorano in pronto soccorso. L’anamnesi e le caratteristiche cliniche del paziente sono cruciali nel riconoscere l’EI che dovrebbe essere sospettata quando, in presenza di febbre, vi è almeno un fattore predisponente.
In conclusione, l’esecuzione rapida “bedside” dell’ETT rappresenta un’importante strumento per la diagnosi precoce dell’EI. La cooperazione tra diverse figure specialistiche (cardiologi, infettivologi, medici di medicina d’urgenza) appare essere fondamentale per trattare pazienti così complessi al fine di ridurre la morbilità e la mortalità correlate all’EI.
Bibliografia
- A. Yang, C. Tan, N. Daneman, M.S. Hansen, G. Habib, E. Salaun, C. Lavoute, S. Hubert, N.K.J. Adhikari; Clinical and echocardiographic predictors of embolism in infective endocarditis: systematic review and meta-analysis; Clinical Microbiology and Infection 25 (2019) 178e187.
- The Task Force for the Management of Infective Endocarditis of the European Society of Cardiology (ESC); 2015 ESC Guidelines for the management of infective endocarditis; European Heart Journal (2015) 36, 3075–3123.
- Sami El-Dalati, Daniel Cronin, Michael Shea, Richard Weinberg,IV James Riddell, Laraine Washer, Emily Shuman, James Burke,Sadhana Murali, Christopher Fagan, Twisha Patel, Kirra Ressler,George Michael Deeb ; Clinical Practice Update on Infectious Endocarditis; The American Journal of Medicine, Volume 133, Issue 1, January 2020, Pages 44-49.
- Jason Arthur, Juvenal Havyarimana, Ashley BoothNorse; Emergency Department Diagnosis of Septic Pulmonary Embolism due to Infectious Endocarditis Using Bedside Ultrasound; The Journal of Emergency Medicine, Volume 55, Issue 3, September 2018, Pages 378-382
- Brit Long, Alex Koyfman; Infectious endocarditis: An update for emergency clinicians; American Journal of Emergency Medicine Volume 36, Issue 9, September 2018, Pages 1686-1692
- Kathieen A Delaney; Endocarditis in the Emergency Department; Annals of Emergency Medicine Volume 20, Issue 4, April 1991, Pages 405-414.
- Michael McCann, Michael Gorman, Barry McKeown; No Fever, No Murmur, No Problem? A Concealed Case of Infective Endocarditis; The Journal of Emergency Medicine Volume 57, Issue 2, August 2019, Pages e45-e48
- Hoen B, Duval X. Infective Endocarditis. N Engl J Med, 2013; 368: 1425-1433.
- Cahill TJ, Prendergast BD. Infective endocarditis. Lancet, 2016; 387: 882-893.