Un ragazzo di 33 anni accede al pronto soccorso per episodio sincopale testimoniato della durata di circa due minuti, sopraggiunto durante attività sportiva, con immediato recupero dello stato di coscienza senza necessità di manovre cardiopolmonari. L’episodio sincopale non era stato preceduto da equivalenti ischemici. Interrogato, riferisce relativo benessere sino a tale evento, ad esclusione di singolo episodio febbrile, regredito tramite utilizzo di paracetamolo, circa un mese prima. Dal raccordo anamnestico si evince familiarità per malattie cardiovascolari, ma negativa per morte improvvisa. Inoltre, il paziente nega pregressi episodi sincopali ed abitudini voluttuarie. Parametri vitali ed esame obiettivo completo risultano nella norma.
In Pronto soccorso, si esegue elettrocardiogramma che mostra: ritmo sinusale con frequenza regolare, conduzione atrio-ventricolare nella norma, blocco di branca destra, emiblocco anteriore sinistro e secondarie anomalie della ripolarizzazione. Posizionando gli elettrodi in modo tale da analizzare il tratto d’efflusso del ventricolo destro, si manifesta un fenotipo suggestivo per sindrome di Brugada di tipo 2, il cosiddetto “Saddle-back pattern” (“aspetto a sella”) in particolare nelle derivazioni precordiali V1-V2. (figura 1-2).
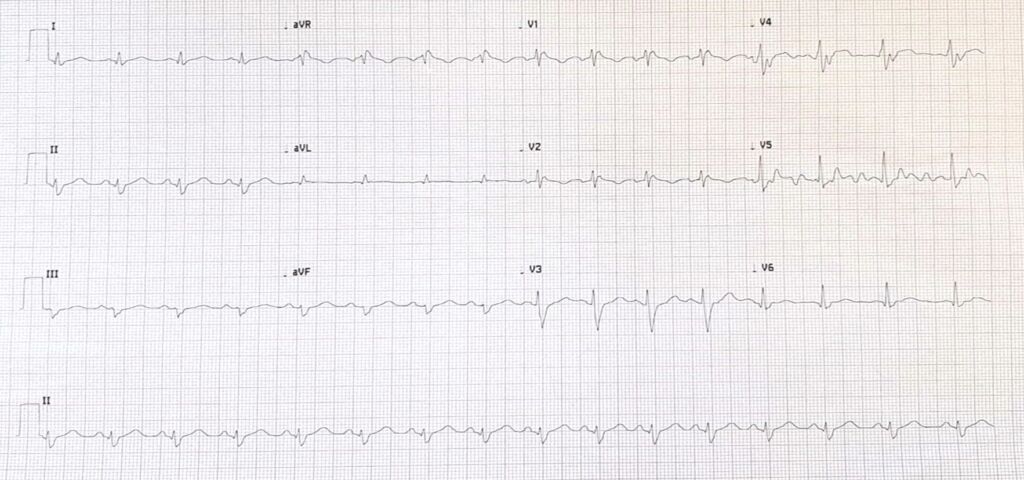
Figura 1. ECG basale

Figura 2. ECG suggestivo per S. Brugada tipo 2, “saddle-back pattern” (“aspetto a sella”)
Agli esami di laboratorio, evidenza di leucocitosi neutrofila (GB 16830/mmc, con 67% neutrofili), associata ad un innalzamento della proteina C reattiva (PCR 10 mg/dL) e lieve rialzo della Troponina I (prima determinazione 93 ng/L, seconda determinazione 190 ng/L, terza determinazione 296 ng/L, con range di normalità <40 ng/L. L’EcoFAst mostra ventricolo sinistro di normali dimensioni e spessori parietali, con funzione sistolica globale ai limiti inferiori della norma (FE 50%) in assenza di chiari deficit della cinesi segmentaria, associata a lieve iperiflettenza del pericardio posteriore. Viene pertanto posta indicazione a ricovero ospedaliero per ulteriori accertamenti del caso.
In reparto, nel sospetto di mio-pericardite acuta, vengono condotti esami ematici per la ricerca di agenti patogeni ed alterazioni immuno-reumatologiche, risultati successivamente negativi. L’ecocardiogramma transtoracico rimarca le alterazioni ventricolari sinistre, in particolare, l’iperiflettenza della parete laterale e del setto interventricolare, ipocinesia della parete laterale e dell’apice e lieve riduzione della funzione sistolica globale (figura 3).
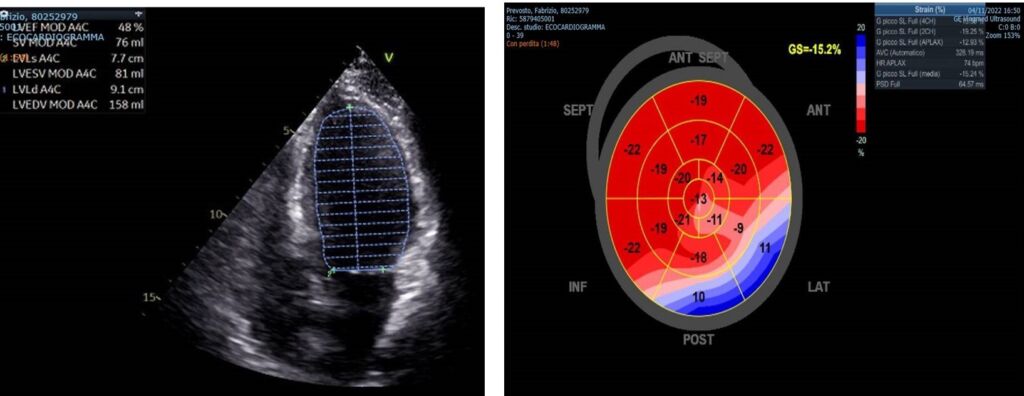
Figura 3. (FE 47%, GLS AVG -15.2%, GLS della parete laterale sinistra -11%).
Per escludere un’origine anomala di un’arteria coronarica (AAOCA), che nel giovane può manifestarsi con arresto cardiaco improvviso, viene eseguita un’angiografia con tomografia computerizzata, in cui non sono presenti anomalie coronariche, oltre ad un bridge intramiocardico dell’IVA distale (figura 4).

Figura 4. Immagine tomografica con segnalato bridge intramiocardioco dell’IVA distale (in rosso)
Successivamente, viene eseguita una RMN cardiaca che ha rilevato dimensioni ventricolari sinistre aumentate con ipocinesia della parete laterale e segmenti apicali, lieve riduzione della funzione sistolica ventricolare globale sinistra, discinesia settale. Nelle acquisizioni T2 TIRM si apprezza iperintensità infra-miocardica a livello della parete antero-laterale ed infero-laterale in sede medio-basale, associata a sfumata iperintensità del pericardio limitrofo in particolare in sede infero-laterale medio-ventricolare, sospette per alterazioni di significato edemigeno. Le acquisizioni LGE mostrano inoltre iperintensità sub-epicardica della parete antero-laterale ed infero-laterale della parete inferiore, associata ad iperintensità del pericardio; ulteriore sfumata iperintensità si apprezza a livello del setto medio in sede infra-miocardica. I reperti descritti appaiono sospetti per condizione di pericardio-miocardite (figura 5).

Figura 5. Sequenze T2 TIRM (A), sequenze LGE (B)
Contestualmente si esegue una biopsia endomiocardica con riscontro di un miocardio con quadro cardiomiopatico lieve, caratterizzato da lieve ipertrofia miocellulare. Un unico frammento bioptico evidenza moderato edema interstiziale con congestione vascolare e vasi con endoteli rigonfi. Non si osservano infiltrati infiammatori (negative le reazioni per CD3, CD20 e CD68). L’assenza di cellule infiammatorie non supporta il sospetto clinico di miocardite attiva, anzi l’alterazione miocellulare suggerisce un quadro cardiomiopatico dilatativo di grado lieve.
In attesa di un’eziologia più chiara della sincope avvenuta, il paziente viene dimesso dopo il posizionamento di un defibrillatore indossabile (WCD, LifeVest, and Zoll), che consente una strategia di vigile attesa in pazienti con rischio aumentato di morte improvvisa.
Oltre ciò, il paziente viene dimesso con indicazione a sottoporsi ad una cardio-RMN di controllo a 3 mesi, allo scopo di monitorare il quadro infiammatorio, e ad intraprendere la seguente terapia: Spironolattone 25 mg, Valsartan 40 mg, terapia cortisonica.
Discussione:
La sincope è definita come una perdita di coscienza transitoria dovuta ad ipoperfusione cerebrale, caratterizzata da un esordio rapido, breve durata e recupero completo spontaneo. A seconda della fisiopatologia sottostante, la sincope può essere distinta in: vaso-vagale, ortostatica e cardiaca. Analizzando nel dettaglio la sincope cardiogena, la prima causa è una bradicardia riflessa, nota come sincope cardioinibitoria riflessa, la seconda riguarda le cause cardiovascolari (aritmia, malattia strutturale, compresa l’embolia polmonare, e ipertensione polmonare), la terza è un ritorno venoso inadeguato dovuto a deplezione di volume o a pooling venoso e infine, l’incompetenza cronotropa 1 (figura 6).

Figura 6. Differenti cause di sincope cardiogena
Il caso clinico in questione indaga quattro possibili cause che possono nascondersi al di là di un episodio sincopale:
- Sindrome di Brugada;
- Origine aortica anomala di un’arteria coronarica (AAOCA);
- Miocardite/pericardite;
- Cardiomiopatie.
La sindrome di Brugada 2 è un disturbo ereditario associato al rischio di fibrillazione ventricolare e morte cardiaca improvvisa in un cuore strutturalmente normale. La diagnosi si basa su un pattern elettrocardiografico caratteristico. I pazienti con sindrome di Brugada possono presentare sincope, convulsioni e respirazione agonica notturna dovuta a tachicardia ventricolare polimorfa (PVT) o PV. Il posizionamento degli elettrocateteri precordiali destri in posizioni più craniali (nel 3° o 2° spazio intercostale) aumenta la sensibilità in alcuni pazienti a causa della variabile correlazione anatomica tra il tratto di efflusso del ventricolo destro e V1 e V2 nella posizione standard. In questo caso specifico, per confermare la diagnosi di sindrome di Brugada, dovrebbe essere eseguito un test con farmaci bloccanti dei canali del Sodio (es.test dell’Ajmalina), ma durante un quadro di sospetta infiammazione miocardica acuta non consigliabile.
La valutazione clinica dei pazienti con un’origine aortica anomala di un’arteria coronaria (AAOCA) 3, è impegnativa dato che spesso la prima manifestazione clinica è l’arresto cardiaco improvviso. Spesso sono necessari ulteriori esami di diagnostica per immagini come ecocardiografia, angiografia con tomografia computerizzata e/o risonanza magnetica cardiaca (RM) per stabilire la diagnosi. Nel nostro caso, l’esame tomografico non ha evidenziato anomalie significative dei segmenti coronarici adeguatamente esplorabili, escludendo che la sincope possa essere dovuta a tale anomalia.
La manifestazione clinica della miocardite acuta4 è generalmente caratterizzata da dolore toracico, dispnea, affaticamento, palpitazioni o sincope. Sulla base di ampi registri, il dolore toracico è il sintomo più frequente (85%-95% dei casi), seguito dalla dispnea (19%-49% dei casi), mentre la sincope si verifica in circa il 6%. L’ECG è anormale in circa l’85% dei casi; l’elevazione del segmento ST che imita l’infarto miocardico acuto è l’anomalia più frequente; Nel nostro scenario, l’unico sintomo osservato è stato un singolo episodio sincopale e in assenza di alterazioni del segmento ST all’ ECG. Anche il monitoraggio degli indici di flogosi e di miocardionecrosi non ha mostrato anomalie durante la degenza. Tuttavia, la RMN cardiaca sembra suggestiva di miocardite/pericardite, in accordo con i criteri di “Lake Louise” 5 (figura 7), esclusa successivamente con i reperti alla biopsia miocardica, che propone un quadro di cardiomiopatia dilatativa di grado lieve, la cui conferma arriverà dall’analisi genetica in corso.

Figura 7. Iperemia: segnale intenso nelle immagini con potenziamento precoce del gadolinio, Edema tissutale: aumento del tempo di rilassamento T2 del miocardio o aumento dell’intensità del segnale nelle immagini pesate in T2, Necrosi/fibrosi: sulla base di immagini con potenziamento tardivo del gadolinio (LGE) – I criteri aggiornati (2018) includono la mappatura T2 per l’edema e la T1 nativa, nonché il volume extracellulare per le lesioni infiammatorie. Se 2 di questi 3 criteri sono positivi, l’AM può essere diagnosticata con una sensibilità del 74% e una specificità dell’86%.
È quindi possibile che due patologie, la sindrome di Brugada e la cardiomiopatia dilatativa, possano coesistere e nascondersi al di là di un episodio sincopale?
Ulteriori prove saranno fornite dai test genetici e dal test dell’Ajmalina, una volta risolto il quadro infiammatorio in atto.
Bibliografia:
1. Brignole M, Moya A, de Lange FJ, Deharo JC, Elliott PM, Fanciulli A, Fedorowski A, Furlan R, Kenny RA, Martín A, Probst V, Reed MJ, Rice CP, Sutton R, Ungar A, van Dijk JG; ESC Scientific Document Group. 2018 ESC Guidelines for the diagnosis and management of syncope. Eur Heart J. 2018 Jun 1;39(21):1883-1948. doi: 10.1093/eurheartj/ehy037. PMID: 29562304.
2. Brugada J, Campuzano O, Arbelo E, Sarquella-Brugada G, Brugada R. Present Status of Brugada Syndrome: JACC State-of-the-Art Review. J Am Coll Cardiol. 2018 Aug 28;72(9):1046-1059. doi: 10.1016/j.jacc.2018.06.037. PMID: 30139433.
3. Molossi S, Agrawal H. Clinical evaluation of anomalous aortic origin of a coronary artery (AAOCA). Congenit Heart Dis. 2017 Sep;12(5):607-609. doi: 10.1111/chd.12505. Epub 2017 Jun 16. PMID: 28621042.
4. Ammirati E, Frigerio M, Adler ED, Basso C, Birnie DH, Brambatti M, Friedrich MG, Klingel K, Lehtonen J, Moslehi JJ, Pedrotti P, Rimoldi OE, Schultheiss HP, Tschöpe C, Cooper LT Jr, Camici PG. Management of Acute Myocarditis and Chronic Inflammatory Cardiomyopathy: An Expert Consensus Document. Circ Heart Fail. 2020 Nov;13(11):e007405. doi: 10.1161/CIRCHEARTFAILURE.120.007405. Epub 2020 Nov 12. PMID: 33176455; PMCID: PMC7673642
5. Ferreira VM, Schulz-Menger J, Holmvang G, Kramer CM, Carbone I, Sechtem U, Kindermann I, Gutberlet M, Cooper LT, Liu P, Friedrich MG. Cardiovascular Magnetic Resonance in Nonischemic Myocardial Inflammation: Expert Recommendations. J Am Coll Cardiol. 2018 Dec 18;72(24):3158-3176. doi: 10.1016/j.jacc.2018.09.072. PMID: 30545455.