Come mostrato dai più recenti studi osservazionali dell’ultimo decennio, la strategia Valve-in-Valve aortica (aViV) per il trattamento della disfunzione di bioprotesi valvolare è diventata una valida alternativa al reintervento cardiochirurgico, soprattutto nei casi più complessi e ad alto rischio1. Tuttavia, nonostante la recente introduzione di metodiche elettrochirurgiche per lacerazione intenzionale delle cuspidi protesiche (BASILICA), la Valve-in-Valve non può essere sempre eseguita in sicurezza, come ad esempio nelle anatomie di piccole dimensioni ad elevatissimo rischio di ostruzione coronarica, dove la chirurgia resta comunque l’unica opzione disponibile. In letteratura sono stati riportati solo alcuni casi di espianto di bioprotesi transcatetere (TAVI)2, ma raramente estrazioni di ViV.
Questo caso clinico riguarda un espianto di ViV eseguito a distanza di soli due mesi dalla procedura, dovuta a trombosi subacuta di bioprotesi transcatetere comportante progressivo scompenso cardiaco.
Il paziente, uomo di 67 anni, nel 2017 era stato sottoposto a sostituzione valvolare aortica con una bioprotesi valvolare chirurgica Hancock II 21 mm (Medtronic Inc., MN, USA) per stenosi aortica severa e ad un concomitante bypass coronarico (graft safeno venoso su interventricolare anteriore). Dopo due anni (Agosto 2019), l’ecocardiogramma transtoracico di controllo ha evidenziato una degenerazione valvolare severa, per cui i Colleghi hanno consigliato al paziente una procedura di ViV aortica, eseguita con protesi CoreValve Evolut R 23 mm (Medtronic Inc., MN, USA) presso altro centro.
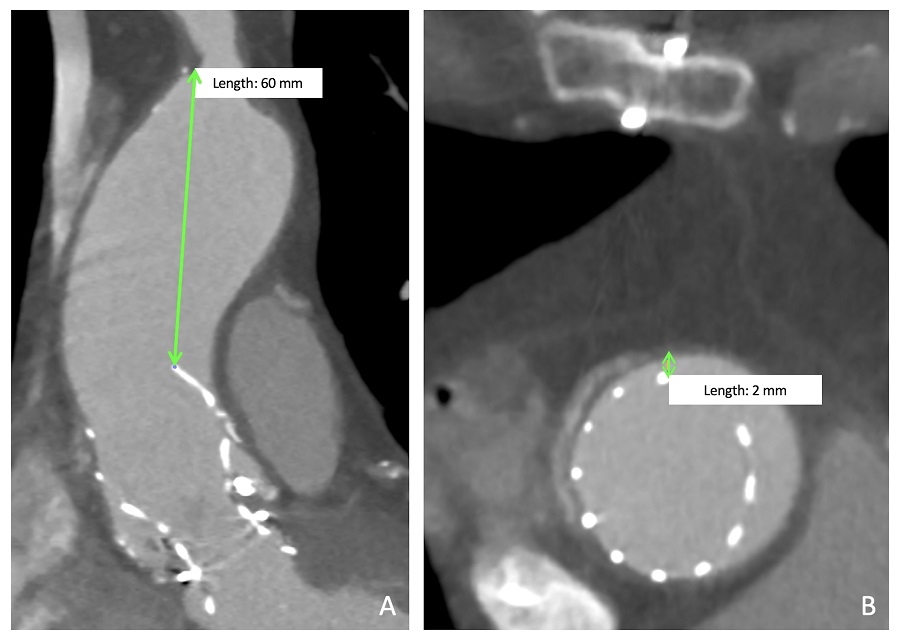
Tuttavia, dopo solo due mesi, il paziente tornò ad essere nuovamente sintomatico con iniziali segni di scompenso e si è rivolto presso il nostro Istituto. L’ecocardiogramma transesofageo ha evidenziato un incremento del gradiente transvalvolare (G medio 45 mmHg; Vmax 4.38 m/s; DVI 0.27), in assenza di rigurgito. Mediante TC cardiaca, tramite ricostruzione 3D ed MPR (multiplanare), è stato possibile progettare una più sicura manipolazione dell’aorta, analisi a nostro giudizio necessaria per pianificare in sicurezza un eventuale reintervento. Infatti, i clamp aortici sono generalmente spessi circa 5 mm, e lo spazio sulla parete aortica richiesto per il clampaggio è poco meno di 2 cm. In questo caso, abbiamo misurato la minor distanza possibile tra THV (protesi transcatetere) ed il punto più inferiore dell’arteria anonima, risultando essere pari a circa 6 cm, ossia di gran lunga sufficiente per consentire una zona di adeguato posizionamento del clamp. Inoltre, misurando sul piano assiale la distanza tra parete aortica e lo stent della THV essa è risultata pari a circa 2 mm, senza un contatto continuo tra maglie metalliche ed endotelio, facilitando pertanto l’eventuale re-aortotomia (Figura 1). Infine, né all’ecocardiogramma né alla TC sono emersi chiari segni di trombosi protesica.
Alla luce di tale quadro, il caso venne discusso collegialmente nel nostro Heart Team e si decise per un reintervento cardiochirurgico con espianto di ViV. Dopo rimozione di tenaci aderenze pericardiche e cannulazione standard centrale, la radice aortica è stata isolata per procedere alla manipolazione aortica: il clamp è stato posizionato in aorta ascendente alta, subito sotto l’ostio dell’arteria anonima, ponendo attenzione ad evitare lo stent della THV sottostante, e l’aortotomia è stata altrettanto eseguita molto superiormente e trasversalmente, evitando l’anastomosi prossimale del precedente bypass venoso pervio. Lo stent endotelizzato della CoreValve è stato rimosso dalla parete aortica mediante pinze e forbici. Bisogna tuttavia ricordare che una più estesa endarterectomia con bisturi o spatola potrebbe rendersi necessaria in caso di tenaci aderenze endoteliali, come riportato in precedenza3. Inoltre, la somministrazione di soluzione fisiologica fredda può favorire il rilascio della tensione nello stent in lega a memoria di forma della protesi transcatetere.
Una volta espiantata, l’analisi macroscopica della THV ha permesso di riscontrare una trombosi subacuta, in un paziente non noto per disordini trombofilici ed in regaolare terapia antiaggregante (Figura 2).
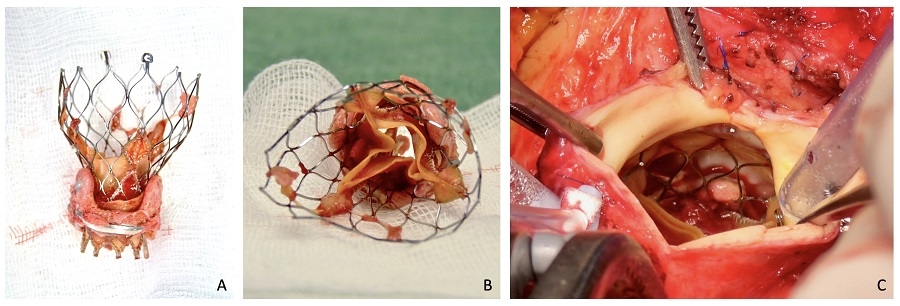
Infine, la bioprotesi chirurgica Hancock II è stata rimossa scollandone la cuffia dall’anulus aortico con il bisturi ed una protesi meccanica Regent 21 mm (Abbott, IL, USA) è stata impiantata con tre emisuture continue.
Dopo un decorso post-operatorio regolare, l’ecocardiogramma transtoracico ha mostrato normali gradienti transprotesici (G medio 14 mmHg).
Il progressivo incremento delle TAVI e la sua continua futura espansione comporteranno verosimilmente un aumento anche delle possibili complicanze sia precoci, che tardive. I futuri cardiologi interventisti e cardiochirurghi si troveranno, pertanto, ad affrontare scenari spesso inattesi. Grazie al miglioramento tecnologico ed all’expertise procedurale, i casi di cardiochirurgia emergente dovute a complicanze periprocedurali legate alla TAVI potrebbero diventare meno significativi in futuro, ma i cardiochirurghi si troveranno più facilmente a gestire altre complicanze delle protesi transcatetere, tra le quali: degenerazione strutturale e non, endocardite, trombosi.
Precedenti studi autoptici hanno evidenziato un progressivo processo di endotelizzazione tale da ricoprire lo stent della bioprotesi transcatetere a partire dai primi tre mesi e tale da completarsi nel giro di un anno circa dopo la procedura. A causa di ciò, le tecniche per una manipolazione aortica sicura dopo TAVI sono state di gran lunga dibattute. Grande variabilità è stata descritta in merito alle metodiche di distacco e disendotelizzazione dello stent delle bioprotesi transcatetere dalla parete aortica (ad esempio endoarterectomia con bisturi o spatola, estrazione mediante pinze/forbici), nonostante i casi necessitanti sostituzione dell’intera radice aortica sono stati relativamente pochi (<15%)4.
La nostra scelta di impiantare una protesi meccanica in un paziente di 67 anni si è basata prevalentemente sulla rapida ed inattesa disfunzione di bioprotesi ViV con repentino peggioramento clinico, tale da non consentire un più lento tentativo di scoagulazione con eparina in vena. Per di più, il rischio chirurgico del reintervento è apparso relativamente basso (STS mortality score 0.949%), nonostante la scelta del precedente centro di eseguire una ViV, verosimilmente giustificata dal voler evitare i rischi legati alla presenza di un bypass venoso pervio che ha richiesto particolare attenzione nelle fasi di rimozione delle aderenze ed un’aortotomia più trasversale.
Grazie ai numerosi dispositivi percutanei recentemente introdotti a seguito dell’avanzamento tecnologico, il cardiologo interventista o cardiochirurgo ibrido di oggi si trova di fronte ad un vasto spettro di alternative. Scegliere l’opzione più giusta per il singolo paziente non è sempre scontato, e l’approccio multidisciplinare in Heart Team probabilmente è quello che consente di andare nella direzione più corretta, avvicinandosi ad una medicina personalizzata anche nell’ambito cardiovascolare.
Seppur saltuariamente descritte, le varie tecniche chirurgiche di espianto di THV sono state ancora poco affrontate. Esse possono risultare in procedure complesse che richiedono mani di chirurghi esperti. Tuttavia, a seconda del grado di endotelizzazione, un’estrazione con pinze e/o endarterectomia mediante bisturi potrebbero essere sufficienti, senza necessitare la sostituzione dell’intera radice aortica. Ulteriori studi sono necessari per comprendere meglio tali riscontri.
Referenze:
- Barbanti M, Webb J, Tamburino C, Van Mieghem NM, Makkar RR, Piazza N et al. Outcomes of Redo transcatheter aortic valve replacement for the treatment of postprocedural and late occurrence of paravalvular regurgitation and transcatheter valve failure. Circ Cardiovasc Interv 2016;9:e003930.
- Hernandez-Vaquero D, Pascual I, Diaz R, Alvarez-Cabo R, Moris C, Silva J. How to perform a late surgical explantation of a Corevalve aortic bioprosthesis. Ann Thorac Surg 2017;103:e565–6.
- Notaristefano F, Reccia MR, Notaristefano S, Annunziata R, Sclafani R, Ambrosio G et al. Bailout surgical explantation of a transcatheter valve-in-valve for subacute thrombosis: when there is no time for anticoagulation. Case report and literature review. Cardiovasc Revasc Med 2018;19:536–539.
- Hirji SA, Percy ED, McGurk S, Malarczyk A, Harloff MT, Yazdchi F, Sabe AA, Bapat VN, Tang GHL, Bhatt DL, Thourani VH, Leon MB, O’Gara P, Shah PB, Kaneko T. Incidence, Characteristics, Predictors, and Outcomes of Surgical Explantation After Transcatheter Aortic Valve Replacement. J Am Coll Cardiol. 2020 Oct 20;76(16):1848-1859.