Dal settembre 2018 una ragazza di 19 anni, che praticava regolare attività fisica aerobica, aveva iniziato a riferire lieve riduzione della tolleranza allo sforzo, con incremento ponderale e senso di gonfiore addominale, per cui si era sottoposta ad un’ecografia dell’addome che aveva evidenziato abbondante versamento ascitico. Veniva inviata in PS e successivamente ricoverata presso la nostra Cardiologia.
Dall’anamnesi patologica personale e familiare non risultava nessun fattore di rischio cardiovascolare, in assenza di familiarità per malattie cardiovascolari; ad un ECG per l’idoneità all’attività sportiva, eseguito nel 2013, si evidenziava aritmia sinusale ed onde T negative da V1-V4.
La paziente non riferiva sintomi di natura cardiovascolare, con una classe funzionale NYHA I. I parametri vitali erano nella norma (PA 120/80 mmHg, FC 60 bpm, Sat O2 99% in AA), apiretica.
All’esame obiettivo si evidenziava un soffio sistolico 3/6 L al mesocardio ed una lieve epatomegalia alla palpazione addominale.
Gli esami ematici, comprensivi di emocromo, funzione epatica e renale, elettroliti, transaminasi, PCR e troponina, risultavano nella norma. NT-pro BNP 498 pg/ml.
Alla radiografia del torace si mostrava cardiomegalia con versamento pleurico basale sinistro.
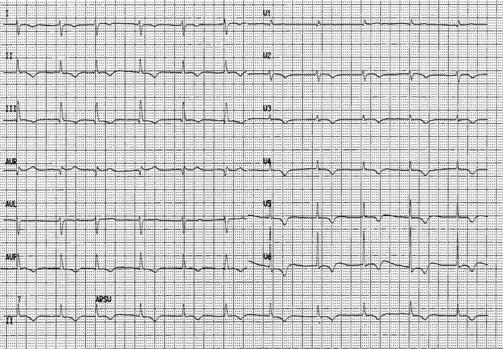
All’ECG evidenza di fibrillazione atriale di nuovo riscontro con FC 60 bpm, ridotti voltaggi, blocco di branca destra incompleto, onde T negative diffuse (Figura 1).
L’ecocardiogramma transtoracico mostrava severa dilatazione ed ipocinesia globale del ventricolo destro con a-discinesia apicale, normali dimensioni e funzione del ventricolo sinistro con FE 56 %; insufficienza tricuspidale massiva da mancata coaptazione dei lembi per dilatazione dell’anello valvolare, vena cava inferiore dilatata senza escursioni respiratorie, severo aumento del volume atriale destro (Figura 2).

Fra gli esami strumentali di II livello sono state effettuate:
- AngioTC arterie polmonari: assenza di segni di embolia polmonare acuta o cronica, arterie polmonari principali di regolari dimensioni; ritorni venosi nella norma.
- Risonanza magnetica cardiaca: ventricolo destro severamente dilatato (Vol td 211 ml/m2), globalmente ipocinetico (FE 22%), a-discinesia apicale in assenza di bulging; aree di ritardato wash out di mdc (LGE+) con pattern inserzionale inferiore come da sovraccarico destro; Qp/Qs:1, indicativo di assenza di shunt (Figura 3).

- Cateterismo cardiaco destro: scompenso cardiaco destro caratterizzato da uguaglianza delle pressioni in atrio destro, ventricolo destro ed arteria polmonare, con normale pressione d’incuneamento capillare e ridotto indice cardiaco a riposo (Figura 4)

- Test da sforzo cardio-polmonare: test massimale, dimostrativo di riduzione della capacità funzionale cardio-respiratoria di grado severo (VO2 max pari a 0,86 l/min, ovvero 45% del teorico; soglia anaerobica pari a 0,54 l/min, ovvero 58% del teorico; VE/VCO2 slope pari a 40; evidenziata incompentenza cronotropa con FC max raggiunta pari a 86 bpm, ovvero 43% del teorico).
Durante il monitoraggio elettrocardiografico esteso durante l’intera degenza evidenziati:
- frequenti battiti ectopici ventricolari (morfologia a blocco di branca sinistra con asse superiore);
- frequenti salve di tachicardia ventricolare non sostenuta (morfologia a blocco di branca sinistra con asse superiore)
- assenza di pause > 2 secondi, sia notturne che diurne, con FC min notturna 38 bpm.
Il quadro clinico strumentale era compatibile con diagnosi di cardiomiopatia aritmogena del ventricolo destro (ARVC), per la quale la nostra paziente rispettava almeno due criteri maggiori (le alterazioni strutturali e funzionali evidenziate all’ecocardiogramma ed alla RM cardiaca, e le aritmie riscontrate, in particolare le TVNS con morfologia a blocco di branca sinistra ed asse superiore).
Il nostro caso si è presentato come “atipico“, confrontandoci con la letteratura1-2-3 relativa alla ARVC, per le seguenti ragioni:
– presentazione precoce: l’età media di presentazione è 36 ± 14 anni;
– esordio con scompenso cardiaco congestizio, mentre nel 60% dei casi di ARVC la presentazione iniziale è dominata dalla comparsa di tachicardia ventricolare (TV) o fibrillazione ventricolare (FV), in assenza di anomalie strutturali evidenti; il cuore della nostra paziente, invece, presentava già una severa riduzione della funzionalità globale del ventricolo destro; inoltre presentava fibrillazione atriale, mentre nelle ARVC non sono comuni alterazioni stabili del ritmo cardiaco;
– i valori misurati di VO2 max al test da sforzo cardio-polmonare, indicativi di severa riduzione dalla capacità cardio-respiratoria della nostra paziente, corrispondono in genere a scadimento rilevante della classe funzionale del paziente, spesso refrattario alla terapia medica; la nostra paziente aveva una classe funzionale NYHA I, divenendo sintomatica solo per carichi di lavoro medio-alti, in assenza di alcuna terapia medica.
PREVENZIONE DELLA MORTE CARDIACA IMPROVVISA
– Perché impiantare un defibrillatore cardiaco in ARVC in prevenzione primaria per morte cardiaca improvvisa (SCD)?
Da dati derivanti dal registro della Johns Hopkins ARVC program4, comprensivo della più grande serie di pazienti con ARVC sottoposti ad impianto di defibrillatore cardiaco (ICD), si evince l’elevata incidenza di interventi appropriati di ICD per qualsiasi aritmia ventricolare sostenuta (22% annualmente) e per fibrillazione ventricolare (3,6% annualmente) nei pazienti con ARVC, e di come, fra i fattori clinici predittori di interventi appropriati di ICD, vi siano l’inversione dell’onda T all’ECG, un alto burden di battiti prematuri ventricolari (all’ECG Holter PVC count > 1000/24 h), giovane età all’impianto dell’ICD, elementi che abbiamo riscontrato nella nostra paziente.
Inoltre, in merito ai predittori di attivazioni appropriate di ICD in prevenzione primaria5, avevamo la presenza di TVNS e la disfunzione ventricolare destra con segni di scompenso cardiaco.
Quindi la nostra paziente presentava un rischio consistente di morte cardiaca improvvisa per cui meritava l’impianto di defibrillatore cardiaco in prevenzione primaria.
– Perché impiantare un defibrillatore cardiaco sottocutaneo (S-ICD) in questo caso?
Dalla letteratura6 emerge che nei pazienti con ARVC, S-ICD è ugualmente efficace rispetto al transvenoso TV-ICD nel trattare TV ed FV. Inoltre le attivazioni inappropriate di TV-ICD (21%) non sono più frequenti di quelle con S-ICD, le quali, mentre con TV-ICD sono maggiormente legate ad aritmie sopraventricolari, con S-ICD sono correlate prevalentemente ad oversensing di onda T e/o miopotenziali. Tale tecnologia permette di evitare le considerevoli morbilità e complicanze a lungo termine del TV-ICD (21%), specialmente nella popolazione giovanile, fra cui ricordiamo frattura e/o dislocamento e/o malfunzione di elettrocatetere e/o generatore, ematoma e/o infezione della tasca e trombosi di vena succlavia. Si segnalavano rari casi di rimozione del device per insorgenza di necessità di antitachycardia pacing.
Pertanto la nostra paziente è stata sottoposta ad impianto di defibrillatore cardiaco sottocutaneo, privilegiando la minor invasità di tale approccio in una paziente che sarebbe entrata prima o poi in lista per trapianto di cuore.
TERAPIA MEDICA
Abbiamo intrapreso una terapia farmacologica comprensiva di DOAC (CHA2DS2Vasc pari a 2 in paziente con fibrillazione atriale permanente) e Furosemide; infatti, nell’ambito dello scompenso cardiaco destro isolato, non sussiste evidenza che la terapia con beta bloccante, ace-inibitore/sartano, diuretico risparmiatore di potassio così come la terapia di resincronizzazione cardiaca possano ridurre la morbilità e mortalità, così come dimostrato per la scompenso cardiaco nell’ambito della disfunzione del cuore sinistro.
COME DEFINIRE IL TIMING PER IL TRAPIANTO DI CUORE?
Da dati derivanti dal Registro ARCV Scandinavo e del Johns Hopkins Hospital, circa il 4% dei pazienti andavano incontro a trapianto di cuore, la cui indicazione deriva prevalentemente dalla presenza di scompenso refrattario alla terapia medica ed in meno del 10% dei casi da aritmie ventricolari refrattarie1.
Tuttavia, i criteri standard per l’indicazione al Trapianto cardiaco (HTx)7 non si applicano necessariamente alle cardiomiopatie del ventricolo destro in stadio avanzato; quanto detto appare lampante nel nostro caso, nel quale la paziente presenta delle caratteristiche emodinamiche per cui, guardando ai dati derivanti dal test da sforzo cardio-polmonare e dal cateterismo cardiaco destro, avrebbe i criteri per essere messa in lista per trapianto di cuore, nonostante una sostanziale asintomaticità a riposo e per bassi carichi di lavoro, per di più vergine da terapia medica.
Al fine di individuare un modello predittivo che ci aiutasse a definire il timing per il trapianto di cuore abbiamo paragonato il suo profilo emodinamico a quello dei pazienti con circolo di Fontain8-9-10, caratterizzato dall’uguaglianza di pressioni in atrio destro, ventricolo destro ed arteria polmonare, tipico di pazienti che, nell’ambito di cardiopatie congenite caratterizzate dalla presenza di un cuore univentricolare su base anatomico-funzionale, sono stati sottoposti alla procedura di Fontan, che, nelle sue varianti, prevede la connessione delle vene cave direttamente alle arterie polmonari, ottenendo la separazione fra circolazione sistemica e circolazione polmonare.
In un circolo Fontan-like, il flusso sanguigno polmonare viene passivamente determinato dal gradiente transpolmonare, dalle variazioni della pressione intratoracica prodotte dal respiro sull’atrio sinistro e dalla “vis a tergo“ del ventricolo sinistro. Pertanto i veri determinanti del circolo sono le resistenze polmonari e la pressione telediastolica del ventricolo sinistro, entrambe normali nella nostra paziente; è proprio in ragione di ciò che la nostra paziente era asintomatica a riposo e per bassi carichi di lavoro, ovvero perchè il circolo dipendeva da determinanti extracardiaci assolutamente normali, mentre per carichi di lavoro più alti, non essendo possibile aumentare il flusso arterioso polmonare vista la mancanza de facto di una pompa ventricolare, la paziente diventava sintomatica, slatentizzando il severo deficit cardio-polmonare, che era stato dimostrato dal test da sforzo cardio-polmonare.
In tale contesto emodinamico, focalizzarsi eccessivamente sull’output cardiaco rischiava di farci perdere di vista l’eccessiva congestione venosa sistemica, vero determinante del fallimento emodinamico di un circolo Fontan-like.

Come illustrato nella figura 5, pazienti con elevato MELD-XI (Model for End-Stage Liver Disease Excluding INR)11, parametro che correla coi valori di bilirubina e creatinina sierica e quindi correla clinicamente col grado di congestione venosa sistemica, saranno caratterizzati, nella fase pre-HTx, da maggiore incidenza di somministrazione di inotropi, ECMO e ventilazione meccanica, e nella fase post-HTx, da una peggiore sopravvivenza se paragonati ai pazienti con MELD-XI basso, sia a 30 giorni dal trapianto, sia ad un uno che a cinque anni (anche nei pazienti con creatinina sierica normale al baseline pre-HTx)12-13.
POINT BREAK
L’equilibrio clinico della nostra paziente è stato interrotto bruscamente da due episodi di TV sostenuta, verificatesi in novembre ed in dicembre 2019, sintomatici per lipotimia, interrotti da scarica appropriata dell’S-ICD.
La presentazione di aritmie maligne reiteranti si è aggiunta ad un quadro emodinamico grave per quanto stabile, senza considerare che è noto10 che, in un circolo Fontan-like, la cardioversione con ritorno al ritmo sinusale dopo intervento appropriato dell’ICD non si traduce immediatamente nel ripristino del ritorno venoso polmonare, che è un prerequisito per il riempimento diastolico del ventricolo sinistro e quindi per la circolazione coronarica e sistemica; in altre parole, tali soggetti sono a maggior rischio di SCD, anche in seguito ad interventi efficaci dell’ICD con pronto ripristino del ritmo sinusale.
L’insieme di queste considerazioni ci ha condotti a quel punto ad inserire la nostra paziente in lista urgente per trapianto di cuore, eseguito di lì a breve, in assenza di complicanze di rilievo nella fase perioperatoria.
L’analisi anatomopatologica del cuore espiantato descriveva:
- un ventricolo destro marcatamente ingrandito con due dilatazioni aneurismariche, la prima a livello del cono di efflusso e la seconda a livello dell’apice, con evidenti aree di infiltrazione fibro-adiposa a livello della parete anterolaterale, nel contesto di un diffuso assottigliamento della pareti della camera ventricolare ed atriale destra;
- nel miocardio del ventricolo destro severo e diffuso infiltrato infiammatorio interstiziale transmurale (75% linfociti T, per il 60% CD8+), che trovava, con medesima composizione, rappresentazione anche nel miocardio del ventricolo sinistro (Figura 6)

Nell’ambito della ARVC, la presenza di un infiltrato infiammatorio, in relazione ad una ricorrente e/o cronica miocardite, costituisce un marker di progressione della patologia e di peggiore outcome della stessa; inoltre questo pattern sembra determinare un’instabilità elettrica del miocardio che favorisce l’insorgenza di tachiaritmie ventricolari e morte cardiaca improvvisa, e col tempo favorisce la progressione dello scompenso cardiaco14.
FOLLOW-UP CLINICO STRUMENTALE POST-TRAPIANTO DI CUORE
La paziente è attualmente asintomatica, con ripresa di blanda attività sportiva.
Gli esami strumentali sono nella norma, con normale emodinamica a riposo ed assenza di rigetto cardiaco, come documentato al cateterismo cardiaco destro con biopsie, eseguiti in maniera seriata nel corso dei mesi successivi.
Prosegue la terapia medica anti-rigetto per trapianto di cuore.
BIBLIOGRAFIA:
- Judith A Groeneweg, Aditya Bhonsale, Cynthia A James, Anneline S te Riele, Dennis Dooijes, Crystal Tichnell, Brittney Murray, Ans C P Wiesfeld, Abhishek C Sawant, Bina Kassamali, Douwe E Atsma, Paul G Volders, Natasja M de Groot, Karin de Boer, Stefan L Zimmerman, Ihab R Kamel, Jeroen F van der Heijden, Stuart D Russell, Maarten Jan Cramer, Ryan J Tedford, Pieter A Doevendans, Toon A van Veen, Harikrishna Tandri, Arthur A Wilde, Daniel P Judge, J Peter van Tintelen, Richard N Hauer, Hugh Calkins. Clinical Presentation, Long-Term Follow-Up, and Outcomes of 1001 Arrhythmogenic Right Ventricular Dysplasia/Cardiomyopathy Patients and Family Members. Circ. Cardiovasc. Genet. 2015.
- Thomas Gilljam, Kristina H Haugaa, Henrik K Jensen, Anneli Svensson, Henning Bundgaard, Jim Hansen, Göran Dellgren, Finn Gustafsson, Hans Eiskjær, Arne K Andreassen, Johan Sjögren, Thor Edvardsen, Anders G Holst, Jesper Hastrup Svendsen, Pyotr G Platonov. Heart transplantation in arrhythmogenic right ventricular cardiomyopathy – Experience from the Nordic ARVC Registry. Int. J Cardiol 2018.
- Weijia Wang, Cynthia A James, Hugh Calkins. Diagnostic and therapeutic strategies for arrhythmogenic right ventricular dysplasia/cardiomyopathy patient. Europace 2019.
- Gabriela M Orgeron, Cynthia A James, Anneline Te Riele, Crystal Tichnell, Brittney Murray, Aditya Bhonsale, Ihab R Kamel, Stephan L Zimmerman, Daniel P Judge, Jane Crosson, Harikrishna Tandri, Hugh Calkins. Implantable Cardioverter-Defibrillator Therapy in Arrhythmogenic Right Ventricular Dysplasia/Cardiomyopathy: Predictors of Appropriate Therapy, Outcomes, and Complications. JAHA, 2017.
- Domenico Corrado, Hugh Calkins, Mark S Link, Loira Leoni, Stefano Favale, Michela Bevilacqua, Cristina Basso, Deirdre Ward, Giuseppe Boriani, Renato Ricci, Jonathan P Piccini, Darshan Dalal, Massimo Santini, Gianfranco Buja, Sabino Iliceto, N A Mark Estes 3rd, Thomas Wichter, William J McKenna, Gaetano Thiene, Frank I Marcus. Prophylactic implantable defibrillator in patients with arrhythmogenic right ventricular cardiomyopathy/dysplasia and no prior ventricular fibrillation or sustained ventricular tachycardia. Circulation 2010.
- Gabriela M Orgeron, Aditya Bhonsale, Federico Migliore, Cynthia A James, Crystal Tichnell, Brittney Murray, Emanuele Bertaglia, Julia Cadrin-Tourigny, Pietro De Franceschi, Jane Crosson, Harikrishna Tandri, Domenico Corrado, Hugh Calkins. Subcutaneous Implantable Cardioverter-Defibrillator in Patients With Arrhythmogenic Right Ventricular Cardiomyopathy/Dysplasia: A Transatlantic Experience. JAHA 2018.
- Mandeep R Mehra, Charles E Canter, Margaret M Hannan, Marc J Semigran, Patricia A Uber, David A Baran, Lara Danziger-Isakov, James K Kirklin, Richard Kirk, Sudhir S Kushwaha, Lars H Lund, Luciano Potena, Heather J Ross, David O Taylor, Erik A M Verschuuren, Andreas Zuckermann, International Society for Heart Lung Transplantation (ISHLT) Infectious Diseases, Pediatric and Heart Failure and Transplantation Councils.
The 2016 International Society for Heart Lung Transplantation listing criteria for heart transplantation: A 10-year update. J Heart Lung Transplant 2016.
- Christiana Schernthaner, Gerhard Poelzl, Bernhard Strohmer, Richard Steinacher, Marcel Granitz, Johann Altenberger. Fontan-like circulation as a criterion for heart transplantation in arrhythmogenic right ventricular dysplasia. Wien Klin Wochenschr 2014.
- Marc Gewillig, Stephen C Brown. The Fontan circulation after 45 years: update in physiology. Heart 2016.
- Thomas Gilljam, Claes-Håkan Bergh. Right ventricular cardiomyopathy: timing of heart transplantation in Uhl’s anomaly and arrythmogenic right ventricular cardiomyopathy. Eur J Heart Fail 2009.
- Douglas M Heuman, Anastasios A Mihas, Adil Habib, Hochong S Gilles, R Todd Stravitz, Arun J Sanyal, Robert A Fisher. MELD-XI: a rational approach to “sickest first” liver transplantation in cirrhotic patients requiring anticoagulant therapy. Liver Transpl 2007.
- Joshua C Grimm, Ashish S Shah, J Trent Magruder, Arman Kilic, Vicente Valero 3rd, Samuel P Dungan, Ryan J Tedford, Stuart D Russell, Glenn J R Whitman, Christopher M Sciortino. MELD-XI Score Predicts Early Mortality in Patients After Heart Transplantation. Ann Thorac Surg 2015.
- Margaret S Kim, Tomoko S Kato, Maryjane Farr, Christina Wu, Raymond C Givens, Ellias Collado, Donna M Mancini, P Christian Schulze. Hepatic dysfunction in ambulatory patients with heart failure: application of the MELD scoring system for outcome prediction. J Am Coll Cardiol 2013.
- D Corrado, C Basso, G Thiene, W J McKenna, M J Davies, F Fontaliran, A Nava, F Silvestri, C Blomstrom-Lundqvist, E K Wlodarska, G Fontaine, F Camerini. Spectrum of clinicopathologic manifestations of arrhythmogenic right ventricular cardiomyopathy/dysplasia: a multicenter study. J Am Coll Cardiol 1997.