Un uomo di 79 anni accedeva in Pronto Soccorso del Policlinico Sant’Orsola Malpighi di Bologna in Settembre 2018 per dispnea ingravescente.
Alla valutazione cardiologica il paziente si presentava tachipnoico, ipoteso e tachicardico (PA: 85/50 mmHg, FC: 100 bpm, SaO2: 91% in aria ambiente). All’esame obiettivo si segnalava la presenza di marcato turgore giugulare.
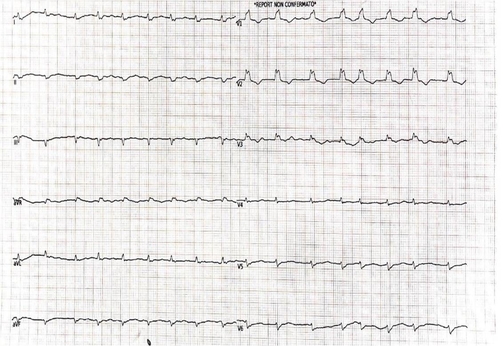
L’ ECG evidenziava fibrillazione atriale con conduzione ventricolare media di 102 bpm, blocco di branca destra con bassi voltaggi diffusi (Figura 1).
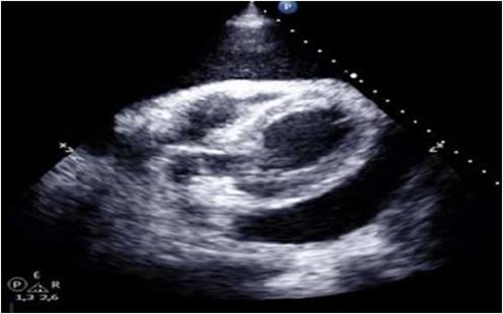
L’ecocardiogramma transtoracico mostrava versamento pericardico severo ubiquitario con segni di compromissione emodinamica (Figura 2).
È stata pertanto posta diagnosi di tamponamento cardiaco ed il paziente è stato condotto in urgenza in emodinamica dove è stato sottoposto a pericardiocentesi percutanea sub-xifoidea con drenaggio di 1000 cc di liquido ematico e successivo ricovero presso la Terapia Intensiva Cardiologica del nostro Centro.
La sua anamnesi patologica remota comprendeva nel 1996 asportazione completa di melanoma (pT1a Breslow 0,3) in regolare follow up, ipotiroidismo in esiti di tiroidite cronica in terapia ormonale sostitutiva ed insufficienza renale cronica stadio IIIA.
Nel Febbraio 2018 era stata posta diagnosi di linfoma non Hodking diffuso a grandi cellule aggressivo (BCL2+, MYC+) con localizzazione sovraclaveare sinistra trattato con chemioterapia R-VNCOP-B (rituximab, etoposide, mitoxantrone, ciclofosfamide, vincristine, prednisolone e bleomicina). La chemioterapia era stata sospesa dopo due mesi per comparsa di fibrillazione atriale per cui era sta intrapresa terapia ipocoagulante con Dabigatran 150 mg bid. Aveva proseguito successivamente cicli di chemioterapia con Rituximab e radioterapia loco-regionale con completa remissione della patologia ematologica in Luglio 2018.
Per definire la diagnosi eziologica dell’emopericardio il pazinete ha eseguito durante il ricovero diversi accertamenti, tra cui:
- Esami ematochimici mostravano normalità dei valori di emocromo, funzione epatica e tiroidea; Creatinina 1,78 md/dL (eGFR Cockroft-Gault 38 ml/min) e urea 66 mg/dL. Spiccava la presenza di un’elevata concentrazione ematica a valle di Dabigatran (204 ng/mL) con INR e aPTT elevati.
- Esami di laboratorio e citologico del liquido pericardico evidenziavano elevati valori di LDH con elementi linfoidi di media e grande taglia con atipie nucleari.
Vista la successiva stabilità emodinamica del paziente in assenza di recidiva di versamento pericardico, dopo sospensione in assoluto della terapia ipocoagulante, nel sospetto di recidiva di malattia ematologica è stata dapprima eseguita una TC del torace con mezzo di contrasto (mdc) che ha mostrato due nodulazioni solide captanti mdc nel contesto di tessuto adiposo epicardico a livello del solco atrio-ventricolare destro (Figura 3).
Il protocollo di imaging multimodale per la caratterizzazione delle masse cardiache applicato nel nostro Centro ha compreso inoltre l’esecuzione di:
- PET-TC con 18-FDG: Ipercaptazione del radiofarmaco a carico delle 2 nodulazioni solide con SUV max del nodulo nella parete libera ventricolare destra di 18.1 e SUV max nodulo solco atrioventricolare destro di 12.8 (Figura 3)
- RM cardiaca con mdc: Due formazioni solide nel grasso sub-epicardico in contiguità con la parete libera del ventricolo destro e del solco atrio-ventricolare con debole enhancement contrastografico (Figura 3)

La diagnosi, confermata anche dall’esito completo citologico del liquido pericardico, è stata quindi di tamponamento cardiaco da emopericardio secondario a recidiva di linfoma non Hodgkin tipo B a grandi cellule in sede pericardica.
Il caso veniva quindi discusso collegialmente con un team multidisciplinare che comprendeva cardiologi, cardiochirurghi ed ematologi. La strategia terapeutica globale ha compreso:
- Non indicazione a rimozione chirurgica delle masse cardiache riscontrate
- E’ stata iniziata terapia ematologica specifica con steroide e ulteriore immunomodulatore (Lenalidomide)
- Alla luce del rischio tromboembolico ed emorragico è stata ripresa gradualmente la terapia anticoagulante con eparina a basso peso molecolare.
A sei mesi di follow up cardiologico il paziente era asintomatico ed in buon compenso cardio-circolatorio con assenza di recidive di versamento pericardico né di altri sanguinamenti per cui è stato eseguito shift con Warfarin.
Dal punto di vista strumentale ad otto mesi risultava la normalizzazione metabolica dei noduli precedentemente descritti nel contesto del tessuto adiposo pericardico che apparivano inoltre notevolmente ridotti per dimensione per cui continuava la medesima terapia ed il follow up ematologico specifico.
Discussione e Conclusione
Nei pazienti con emopericardio non secondario a traumi né procedure invasive l’eziologia neoplastica deve essere sempre sospettata.
Il tumore al polmone è la neoplasia primitiva che con più elevata prevalenza può determinare un coinvolgimento del pericardio. Meno frequentemente vi sono i tumori maligni mammari, esofagei, melanomi e patologie emolinfoproliferative 1,2.
Dal punto di vista della gestione del tamponamento cardiaco è ovviamente necessario eseguire in urgenza una pericardiocentesi evacuativa preferibilmente percutanea ma anche chirurgica in casi selezionati (classe IC) 3.
Nelle raccomandazioni delle linee guida ESC riguardo la gestione dei pazienti con sospetto di coinvolgimento neoplastico del pericardio, un ruolo primario spetta alla citologia del liquido pericardico per confermare la malignità del versamento pericardico (classe IB) mentre più raramente si rende necessario eseguire una biopsia diretta del tessuto pericardico interessato dal processo neoplastico (IIA) 3.
Oggi grazie alle metodiche di imaging multimodale è possibile una corretta diagnosi di malignità della massa pericardica, oltre che ad una stadiazione completa della patologica. Oltre all’ecocardiogramma, che rappresenta l’esame strumentale di primo livello, come metodiche di secondo livello si utilizzano TC con mdc, ma soprattutto PET con 18-FDG4 e infine RM cardiaca con mdc5 per la caratterizzazione rispettivamente dell’attività metabolica e delle caratteristiche tissutali nonché dell’invasività della sospetta massa pericardica.
Tali metodiche di imaging, integrate alla valutazione con citologia del liquido pericardico, sono di estrema utilità per la diagnosi eziologica e la successiva migliore gestione multidisciplinare (cardiologica, oncologica/ematologica e cardiochirurgica) di masse pericardiche/cardiache come nel caso del nostro paziente con tamponamento cardiaco da versamento ematico neoplastico.
Bibliografia:
- Atar S, Chiu J, Forrester JS, Siegel RJ. Bloody pericardial effusion in patients with cardiac tamponade: is the cause cancerous, tuberculous, or iatrogenic in the 1990s? Chest. 1999;116:1564.
- Abraham KP, Reddy V, Gattuso P. Neoplasms metastatic to the heart: review of 3314 consecutive autopsies. Am J Cardiovasc Pathol. 1990;3:195.
- Yehuda Adler, Philippe Charron, Massimo Imazio, Luigi Badano, Gonzalo Barón-Esquivias, Jan Bogaert, Antonio Brucato, Pascal Gueret, Karin Klingel, Christos Lionis, Bernhard Maisch, Bongani Mayosi, Alain Pavie, Arsen D Ristić, Manel Sabaté Tenas, Petar Seferovic, Karl Swedberg, Witold Tomkowski, ESC Scientific Document Group, 2015 ESC Guidelines for the diagnosis and management of pericardial diseases: The Task Force for the Diagnosis and Management of Pericardial Diseases of the European Society of Cardiology (ESC). European Heart Journal, Volume 36, Issue 42, 7 November 2015, Pages 2921–2964
- D’Angelo EC, Paolisso P, Vitale G, Foà A, Bergamaschi L, Magnani I, Saturi G, Rinaldi A, Toniolo S, Renzulli M, Attinà D, Lovato L, Lima GM, Bonfiglioli R, Fanti S, Leone O, Saponara M, Pantaleo MA, Rucci P, Di Marco L, Pacini D, Pizzi C, Galiè N. Diagnostic Accuracy of Cardiac Computed Tomography and 18F-Fluorodeoxyglucose With Positron Emission Tomography in Cardiac Masses. JACC Cardiovasc Imaging. 2020 Jun 17:S1936-878X(20)30331-4
- Pablo Pazos-López, Eduardo Pozo, Maria E Siqueira, Inés García-Lunar, Matthew Cham, Adam Jacob, Frank Macaluso, Valentín Fuster, Jagat Narula, Javier Sanz. Value of CMR for the Differential Diagnosis of Cardiac Masses. JACC Cardiovasc Imaging. 2014;7:896